人肝癌细胞SNU-398
发表时间:2025-07-17人肝癌细胞SNU-398
一、细胞起源与来源
1.来源背景:SNU-398细胞系源自韩国患者的肝癌组织,于1996年由首尔国立大学建立,属于低分化肝细胞癌(HCC)模型[1][2]。
2.病理特征:原始肿瘤组织呈低分化形态,细胞表现出非典型上皮样结构和高侵袭性。
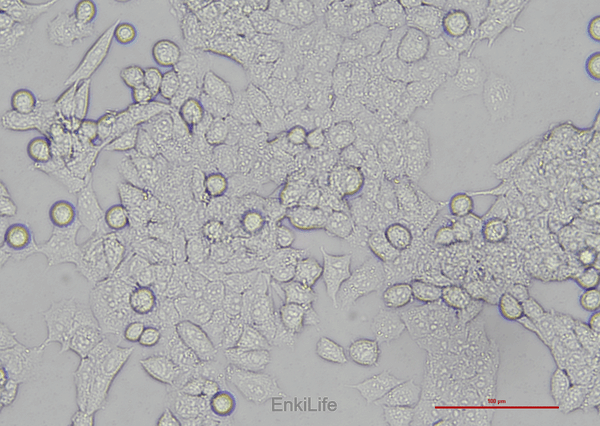
二、生物学特性
1. 形态与增殖特性
- 形态学:呈纺锤形或多边形,贴壁生长能力弱,易形成悬浮聚集[1]。
- 增殖依赖:高度依赖精氨酸(Arg),SLC7A1基因介导的精氨酸摄取是其增殖关键[4]。敲低SLC7A1显著抑制增殖(p<0.05)[4]。
2. 分子特征
- 癌基因表达:高表达癌胚基因SALL4A(约450倍)和SALL4B(约270倍),与侵袭性正相关[2]。过表达TATA-box结合蛋白(TBP)促进上皮-间质转化(EMT),增强迁移和侵袭[5]。
- 非编码RNA调控:RAB11B-AS1(lncRNA)高表达促进增殖和转移,其敲低可抑制迁移/侵袭并诱导凋亡[6]。miRNA-124通过下调ROCK1抑制UCA1(lncRNA),抑制增殖[7]。
3. 信号通路
- Notch通路:SKA3基因激活Notch信号(NICD、Hes1上调),维持干细胞样特性[8]。
- 代谢特征:肿瘤微环境缺氧比例高,可能影响化疗耐药性[9]。
三、培养与储存
1.培养基:推荐使用RPMI-1640+10% FBS+1% P/S[3]。
2.传代与冻存:传代比例1:2-1:4,消化时间≤3分钟(0.25%胰酶)[3]。冻存液:30%基础培养基+60%FBS+10%DMSO,液氮保存[3]。
四、研究应用领域
1.药物筛选平台:
- Azaindole(7-氮杂吲哚)靶向KIFC1抑制增殖,体内外均显效[10]。
- 灯台叶醇提物(2.0 mg/mL)抑制率达83.6%[11]。
2.转移机制研究:用于EMT、缺氧微环境、外泌体(如ANXA2+外泌体促转移)等研究[5][9][12]。
3.干细胞特性:高表达CD133等干细胞标志物,用于肿瘤干细胞(CSCs)研究[12]。
五、近五年研究进展(2020-2025)
1.靶向治疗:
- Azaindole通过下调KIFC1抑制SNU-398增殖,动物实验显示肿瘤体积缩小50%[10]。
- METTL16介导m6A修饰下调RAB11B-AS1,抑制迁移/侵袭(p<0.01)[6]。
2.代谢干预:精氨酸剥夺联合GCN2抑制剂可诱导衰老,增强化疗敏感性[4]。
3.天然产物:芡实壳醇提物(IC50=148.51 μg/mL)显著抑制增殖[13]。
六、局限性与克服方法
|
局限性 |
克服方法 |
|
低分化特性:分子异质性强[1] |
单细胞测序解析亚群[6] |
|
缺氧微环境:致化疗抵抗[9] |
联合缺氧激活前药(如PR-104)[9] |
|
转移模型不足:缺乏原位移植模型[5] |
建立PDX模型[12] |
七、总结与展望
SNU-398是研究低分化HCC的理想模型,尤其在精氨酸代谢、lncRNA调控和转移机制中价值显著。
展望:
1.联合靶向治疗:如Azaindole + 免疫检查点抑制剂[10]。
2.临床转化:基于RAB11B-AS1或SALL4的液体活检标志物开发[2][6]。
3.多组学整合:结合空间转录组解析肿瘤微环境异质性[9]。

参考文献
1. Differential expression of Caveolin-1 in hepatocellular carcinoma: correlation with differentiation state, motility and invasion. Cokakli M, et al. J Pathol. 2009;218(4):487-92. [PMID: 19402053]
2. Oncofetal gene SALL4 in aggressive hepatocellular carcinoma. Ong KJ, et al. N Engl J Med. 2013;368(8):733-45.[ PMID: 23425166]
3. 人肝癌细胞SNU-398说明书.武汉恩玑生命科技有限公司.
4. GCN2 inhibition sensitizes arginine-deprived hepatocellular carcinoma cells to senolytic treatment. Missiaen R, et al. Cell Metab. 2022;34(7):1-17. [PMID: 35700708]
5. TATA-box-binding protein promotes hepatocellular carcinoma metastasis through epithelial-mesenchymal transition. Cao J, et al. Cancer Sci. 2023;114(6):2374-2384. [PMID: 36840335]
6. METTL16 promotes hepatocellular carcinoma progression through downregulating RAB11B-AS1 in an m6A-dependent manner. Dai YZ, et al. Oncogene. 2022;41(22):3050-3062. [PMID: 35508723]
7. MiRNA-124 inhibits the proliferation, migration and invasion of cancer cell in hepatocellular carcinoma by downregulating lncRNA-UCA1. Zhao B, et al. J Cell Biochem. 2019;120(6):10145-10152. [PMID: 30614083]
8. Spindle and kinetochore-associated complex subunit 3 (SKA3) promotes stem cell-like properties of hepatocellular carcinoma cells through activating Notch signaling pathway. Bai S, et al. Cancer Lett. 2021;499:177-183.[ PMID: 33493594]
9. Pre-clinical activity of PR-104 as monotherapy and in combination with sorafenib in hepatocellular carcinoma. YAbbattista MR, et al. Cancer Chemother Pharmacol. 2015;75(4):791-801. [PMID: 25663532]
10. Azaindole inhibits liver cancer cell proliferation in vitro and in vivo by targeting the expression of kinesin family member C1. You Z, et al. J Exp Clin Cancer Res. 2022;41(1):22. [PMID: 35016633]
11. 韩芳. 灯台叶醇提物体外抗肿瘤作用研究. 中国实验方剂学杂志. 2013;19(2):163-169.
12. 潘韵芝, 马赛, 曹凯悦, 等. 高表达ANXA2肝癌干细胞外泌体对肝癌细胞恶性生物学特性的调控作用. 中国癌症杂志. 2019;29(4):241-243.
13. 王俊南, 等. 水生蔬菜提取物抑制人肝癌HepG2细胞增殖. 食品科学. 2020;41(5):1-7.




