人结肠腺癌细胞SW948
发表时间:2025-07-15人结肠腺癌细胞SW948
一、细胞起源
起源:SW948源于人结肠腺癌组织,属于结直肠腺癌(CRC)细胞模型,具有典型的腺癌病理特征。由美国ATCC细胞库收录(编号HTB-39),分离自结肠癌患者原发肿瘤组织,常用于结直肠癌分子机制研究[1]。
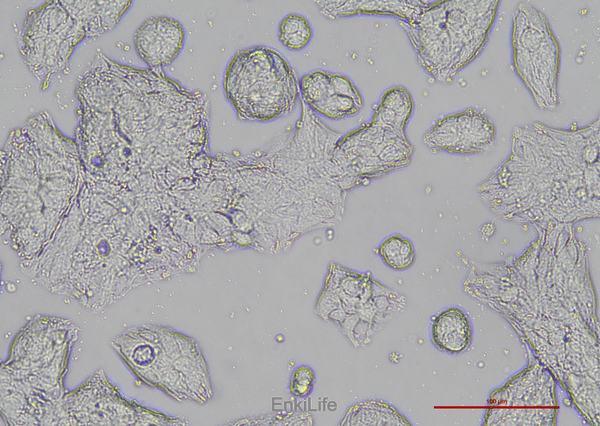
二、生物学特性
1. 形态特征:贴壁生长,呈多边形或梭形,核质比高,符合腺癌细胞典型形态[1]。
2. 分子特征:
l 基因突变:携带PIK3CA基因突变(催化亚基p110α突变),导致PI3K/AKT信号通路持续激活[1]。
l 代谢表型:表现为Warburg效应(糖酵解主导),高葡萄糖消耗,GLUT1表达随环境葡萄糖浓度动态调节[2]。
l 表面受体:高表达IGF-1R(胰岛素样生长因子1受体),与凋亡抵抗相关[3]。
3. 功能特性:
l 增殖与凋亡:PIK3CA突变驱动细胞快速增殖,凋亡抑制(Bcl-2家族表达异常)[1]。
l 耐药性:对TRAIL(肿瘤坏死因子凋亡诱导配体)诱导的凋亡具有抵抗性,需联合IGF-1R抑制剂增敏[3]。
三、培养与储存
1. 培养条件:DMEM+10% FBS+1% P/S, 37℃、5% CO?环境[4]。
2. 葡萄糖依赖性:增殖速率受培养基葡萄糖浓度影响,低糖条件可诱导GLUT1表达上调[2]。
3. 储存方法:30%基础培养基+60%FBS+10%DMSO,液氮保存[4]。
四、研究应用领域
1. 信号通路研究:
PI3K/AKT通路机制验证:PIK3CA-shRNA可显著抑制增殖并诱导G1/S期阻滞[1]。
2. 药物筛选平台:
天然产物抗肿瘤评价(如黑莓叶提取物抑制SW948存活率34%)[5]。
二甲双胍代谢干预研究:低糖条件下药物敏感性增强[2]。
3. 凋亡机制研究:
IGF-1R抑制剂联合死亡受体激动剂可克服凋亡抵抗[3]。
五、近几年研究进展(2020–2025)
1. 代谢适应性机制:
2021年研究发现SW948在低糖环境下通过上调GLUT1维持糖酵解,但对二甲双胍的敏感性在高糖条件下降低[2]。
2. 靶向治疗新策略:
PI3Kα特异性抑制剂(如Alpelisib)联合凋亡诱导剂可增强抗肿瘤效果[1][3]。
3. 天然产物研究:
植物多酚(鞣花酸、黄酮类)通过氧化应激途径抑制SW948增殖[5]。
六、局限性与克服方法
1. 局限性:
代谢异质性:细胞亚群对葡萄糖利用效率差异大,影响药物响应一致性[2]。
突变复杂性:除PIK3CA外,其他基因突变(如KRAS)未被充分研究[1]。
2. 克服方法:
联合治疗:IGF-1R抑制剂(NVP-AEW541)联合rhTRAIL可逆转凋亡抵抗[3]。
类器官模型:构建SW948患者来源类器官(PDO),模拟肿瘤微环境异质性[2]。
七、总结与展望
SW948作为PIK3CA突变型结肠癌的关键模型,在信号通路、代谢重编程及耐药机制研究中具有不可替代的价值。未来研究需聚焦:
1. 多组学整合:结合单细胞测序解析亚群异质性。
2. 精准治疗开发:针对PIK3CA突变设计小分子抑制剂联合免疫疗法。
3. 临床转化:利用PDO模型预测患者个体化用药响应[1][2]。

参考文献
1. Huang WS, Wang TB, He Y, et al. Phosphoinositide-3-kinase, catalytic, alpha polypeptide RNA interference inhibits growth of colon cancer cell SW942. Mol Med Rep. 2012;6(3):675-673. PMID: 22684278 .
2. Alhourani AH, Tidwell TR, Bokil AA, et al. Metformin treatment response is dependent on glucose growth conditions and metabolic phenotype in colorectal cancer cells. Sci Rep. 2021;11(1):10484. PMID: 34006333 .
3. Pennarun B, Kleibeuker JH, Oenema T, et al. Inhibition of IGF-1R-dependent PI3K activation sensitizes colon cancer cells specifically to DR5-mediated apoptosis but not to rhTRAIL. Cancer Res. 2010;70(22):248-255. PMID: 21062979 .
4. 人结肠腺癌细胞SW948 说明书.武汉恩玑生命科技有限公司.
5. Grochowski DM, Paduch R, Wiater A, et al. In Vitro Antiproliferative and Antioxidant Effects of Extracts from Rubus caesius Leaves and Their Quality Evaluation. Molecules. 2016;21(12):1741. PMID: 27999389.




