免疫荧光VS多重免疫荧光
发表时间:2025-10-17??科研宝子们看过来!今天带大家了解「免疫荧光 IF」vs「多重免疫荧光 mIHC」
?收藏这篇推文,选对方法不踩坑!
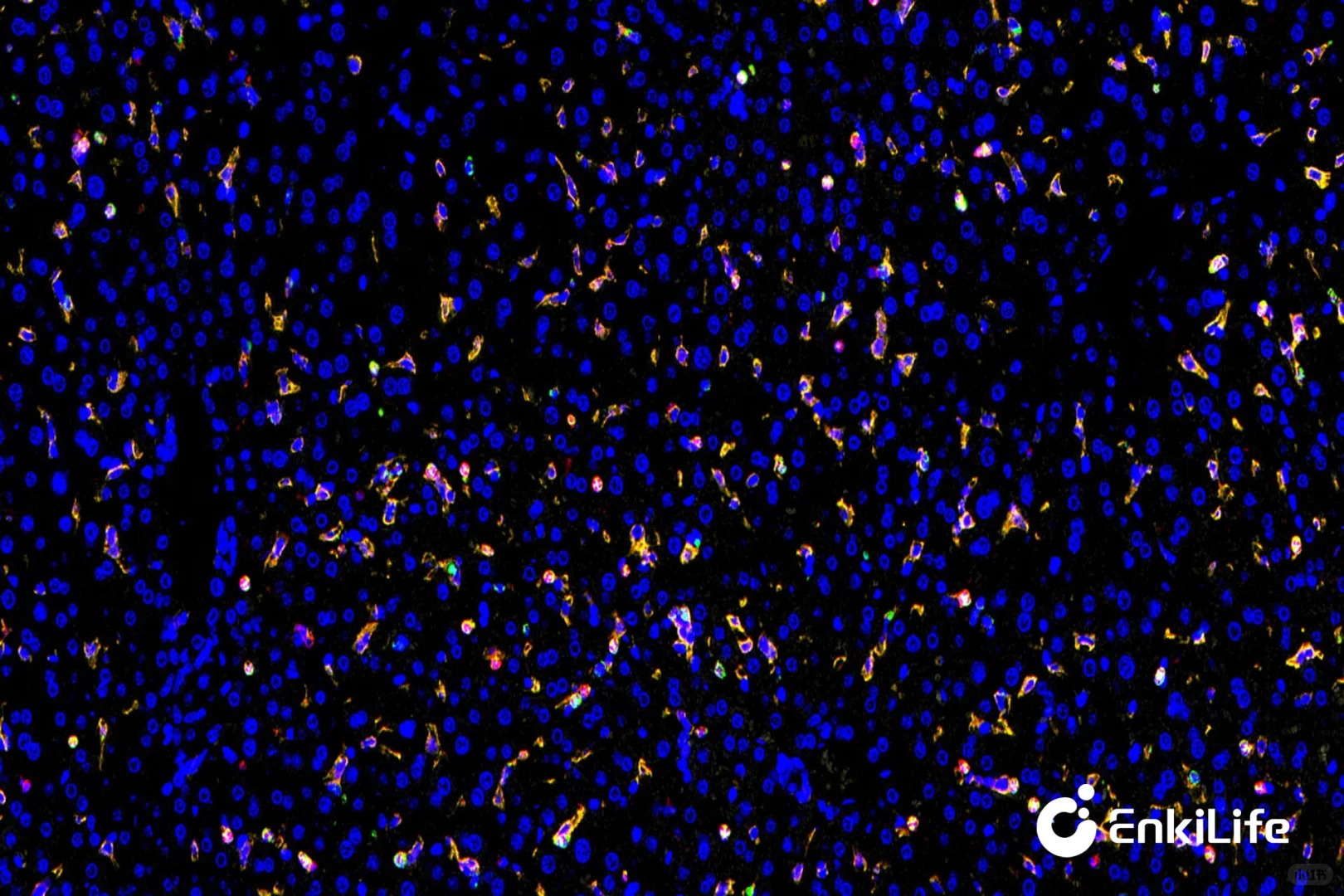
??免疫荧光:
?基本原理:抗原-抗体特异性结合,利用荧光素(如FITC、Alexa Fluor)标记抗体,激发后发出荧光信号进行检测。
?信号放大机制:通常采用直接标记或间接二抗放大,信号强度有限。
?光谱处理:单一通道检测。
?优势:
?操作简便:单轮染色即可完成,实验周期短,流程易掌握。
?成本低廉:整体实验成本较低。
?技术门槛低:大多数实验室已配备常规荧光显微镜,常规实验室即可开展。
?适合快速验证:适用于初步验证,尤其适合早期探索性研究。
??劣势:
?检测通量:通常≤3种抗原,受限于抗体种属;荧光通道数量。
?重复验证耗时:若需研究多个标志物,需多次切片/多次实验,增加样本消耗与批次差异。
?缺乏空间维度信息:无法同时展示多种抗原的共定位或空间互作关系,难以解析复杂微环境。
??多重免疫荧光:
?基本原理:同样基于抗原-抗体结合,但通过多轮染色+信号放大(TSA),实现多个抗原在同一组织切片上的同时检测。
?信号放大机制:引入酪胺信号放大(TSA):HRP催化荧光酪胺沉积,实现信号增强与稳定标记。
?光谱处理:多光谱成像。
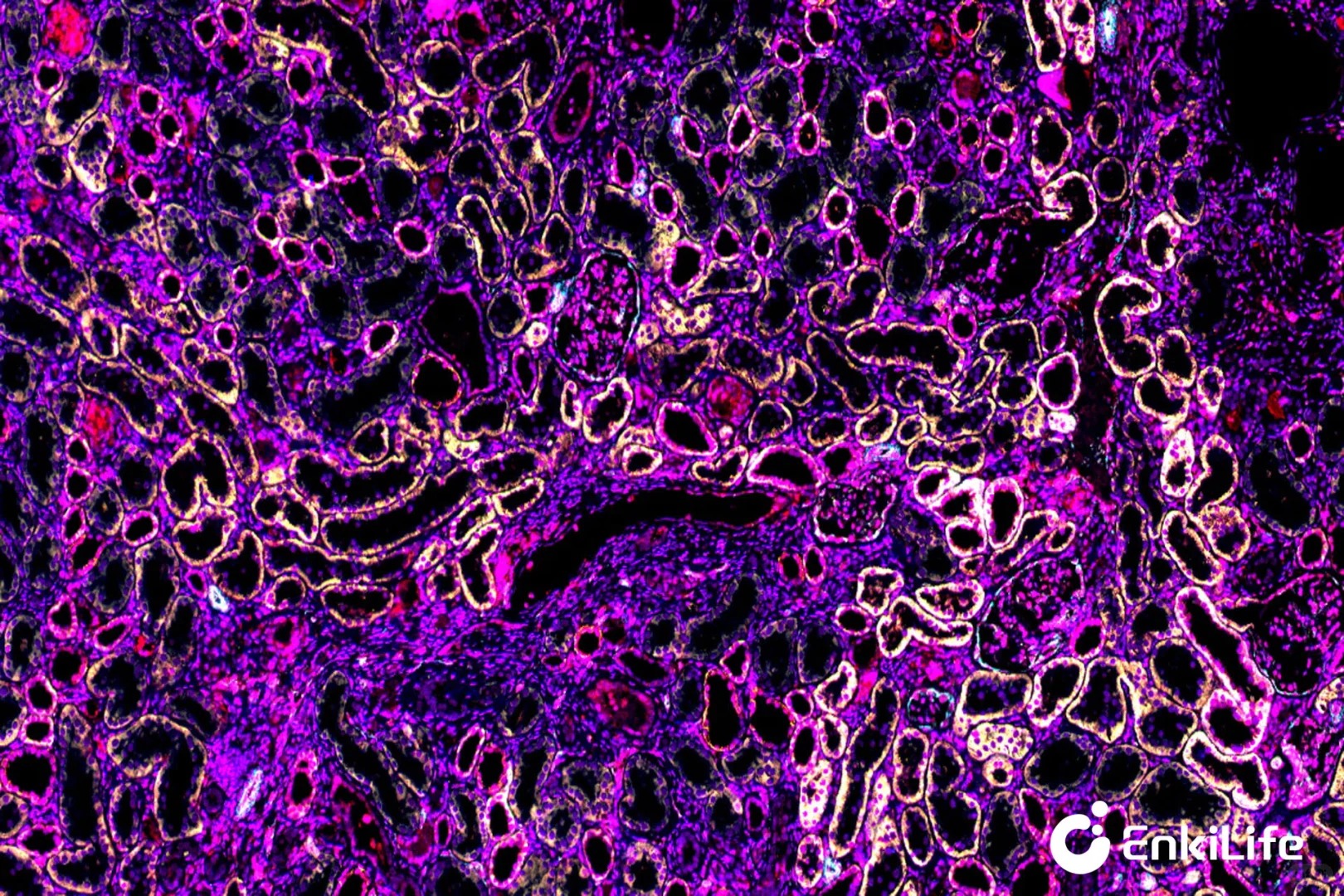
?优势:
?检测通量:高,可同时检测多种抗原。
?信号放大:TSA(酪胺信号放大)使低丰度抗原可检,灵敏度提升10–100倍。
?一次实验可获取多维数据,实现多抗原空间共定位分析。
?适用于肿瘤免疫微环境分型,生物标志物共表达分析等前沿研究。
??劣势:
?流程复杂:需经历多轮实验,操作难度较大,耗时长。
?成本高昂:TSA染料、光谱成像系统等费用数倍于IF。
?技术门槛高:需优化抗体顺序、光谱解混参数,对人员和设备都有较高要求。
?光漂白:荧光信号减弱,重复扫描困难。
??一句话总结怎么选?
? 只想验证1-2个marker?IF足够!
? 想画“肿瘤免疫微环境地图”?直接冲mIHC!
?如果你有任何疑问,或者想要了解更多关于mIHC、IF的信息,欢迎在评论区留言哦!??




