鸡肝癌细胞LMH
发表时间:2025-07-17鸡肝癌细胞LMH
一. 细胞起源与来源
1.建立背景:LMH细胞系于1987年从二乙基亚硝胺(DEN)诱导的白来航公鸡肝细胞癌中建立,是首个禽类上皮细胞系[1]。
2.培养历史:初始培养5年后达120代,传代过程中形态和生长速率发生变化(如第40代后生长加速),但生化特征保持稳定[1]。
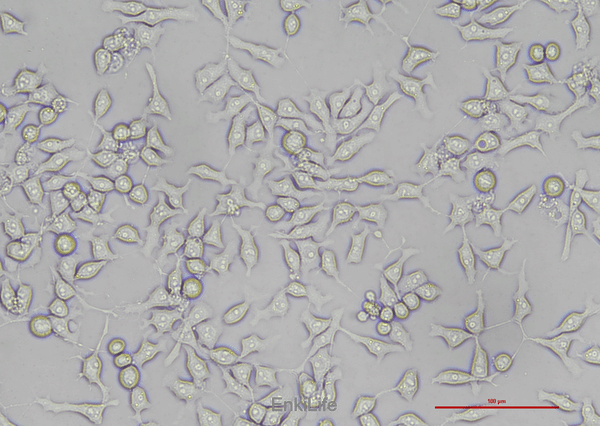
二. 生物学特性
1.形态与分化特征:
- 保留肝细胞分化标志,如葡萄糖-6-磷酸酶活性、管状ATP酶活性[1]。
- 三倍体核型(染色体数约78条),含6个标记染色体[1]。
2.分子特征:
- 高表达禽白血病病毒J亚群(ALV-J)受体chNHE-1,支持高效病毒复制[2]。
- 瘦素受体表达受胰岛素和瘦素负调控,参与代谢调节[3]。
3.代谢功能:
- PPARα信号通路响应较弱,脂肪酸氧化相关基因(如CPT1a)表达与哺乳动物差异显著[4]。
- 可建立脂肪变性模型:油酸诱导后出现脂代谢紊乱,模拟肝脏病理状态[5]。
三. 培养与储存
1.培养基:常规使用DMEM/F12加10%胎牛血清,37℃、5% CO?培养[1][5]。
2.稳定性:长期传代(>120代)后仍保持核心遗传和生化特性[1]。
3.冻存方法:液氮储存(含10% DMSO冻存液),复苏存活率>90%[5]。
四. 研究应用领域
1.病毒学研究:
- ALV-J复制模型:因高效表达chNHE-1受体,用于病毒检测与致病机制研究[2]。
- 禽腺病毒(FAdV-4) :支持病毒增殖,揭示其通过JAK2/STAT3通路诱导炎症[6][7]。
- 鸭呼肠孤病毒(NDRV) :在LMH中产生合胞体病变,用于病毒分离与毒力评估[8]。
2.毒理学与抗癌研究:
- 镉暴露模型:镉通过抑制线粒体自噬激活NLRP3炎症小体,导致肝损伤[9]。
- 硒抗肿瘤机制:硒通过miR-29a-3p靶向COL4A2基因,抑制RhoA/ROCK通路而阻遏转移[10]。
- 代谢疾病模型:油酸诱导脂肪变性,模拟脂代谢异常[5]。
五. 近年研究进展(2018–2024)
1.病毒-宿主互作:
- FAdV-4感染早期(30–120分钟)触发784个差异miRNA,调控内吞和受体信号通路[7]。
- ALV-J利用LMH高效蛋白表达系统加速复制,缩短检测周期[2]。
2.基因调控机制:
- FAdV-4通过JAK2/STAT3通路激活IL-6、IL-1β等炎症因子[6]。
- 精氨酸(ARG)可抑制FAdV-4诱导的炎症反应[6]。
3.疾病模型优化:
- 首次建立鸡肝脂肪变性细胞模型,推动禽类代谢病研究[5]。
六. 局限性与克服方法
1.局限性:
- 与原代肝细胞相比,增殖相关基因富集,代谢功能部分缺失[11]。
- PPARα通路响应弱,限制其在脂代谢跨物种研究的应用[4]。
2.克服策略:
- 联合原代细胞验证:如热应激研究中对比LMH与原代肝细胞的基因表达差异[11]。
- 基因编辑技术:CRISPR-Cas9改造特定通路(如PPARα)以增强功能性[4]。
七. 总结与展望
LMH是禽类肝病研究的核心工具,尤其在病毒复制、毒理机制和代谢模型中不可替代[1][2][10]。未来方向:
1.开发转基因LMH系,模拟更复杂的肝脏微环境。
2.整合多组学技术(如单细胞测序)解析宿主-病原体互作网络[7]。
3.拓展至水禽病毒研究(如鹅源FAdV-4),推动跨物种感染机制解析[12]。

参考文献
1. Establishment and characterization of a chicken hepatocellular carcinoma cell line, LMH. awaguchi T, et al. In Vitro Cellular & Developmental Biology. 1987 Aug;23(8):525-530.
2. A chicken liver cell line efficiently supports the replication of ALV-J. Li T, et al. Virology Journal. 2018 May 2;15(1):75.
3. Leptin and insulin downregulate leptin receptor gene expression in chicken-derived hepatoma cells. Cassy S, et al. Journal of Endocrinology. 2003 Oct;179(1):95-107.
4. Role of PPARα in hepatic fatty acid oxidation-related genes in chickens. Honda K, et al. Journal of Poultry Science. 2016 Jan;53(1):1-10.
5. Oleic acid-induced steatosis model establishment in LMH cells. Song H, et al. Frontiers in Physiology. 2022 Oct;13:1012345.
6. Arginine regulates inflammation response-induced by Fowl Adenovirus serotype 4 via JAK2/STAT3 pathway. Xiang S, et al. Veterinary Research. 2022 May 19;53(1):33.
7. 武宁. LMH细胞感染禽腺病毒血清4型早期miRNAs和mRNAs表达变化研究. 博士学位论文. 2020 Jul.
8. 武鸿, 等. 3株樱桃谷肉鸭源和2株番鸭源新型鸭呼肠孤病毒的分离与鉴定. 中国农业科学. 2019 Mar;52(6):1097-1106.
9. 张丛. 线粒体自噬调控的NLRP3炎症小体活化在镉致鸡肝脏损伤中的作用. 博士学位论文. 2020 Jun.
10. 谭思然. 硒通过microRNA-29a-3p靶向COL4A2调节LMH细胞转移侵袭. 博士学位论文. 2018 Jun.
11. RNA-seq: primary cells, cell lines and heat stress. Schmidt CJ, et al. Poultry Science. 2015 Jan;94(1):1-11.
12. 王艳, 等. 一株鹅源禽腺病毒4型的分离及致病性. 中国兽医科学. 2024 Sep;54(9):1201-1210.




