人单核细胞THP-1
发表时间:2025-07-17人单核细胞THP-1
一、细胞起源
1.建立背景:THP-1细胞系于1980年由Tsuchiya等从一名急性单核细胞白血病(AML)患儿的血液中分离建立,是首个被鉴定具有明确单核细胞标志的白血病细胞系[1]。
2.遗传背景:细胞携带HLA单倍型:HLA-A2、-A9、-B5、-DRW1和-DRW2,无Epstein-Barr病毒抗原[1]。
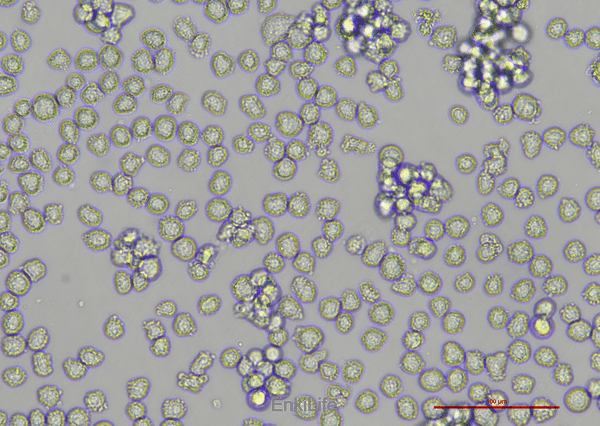
二、生物学特性
1.形态与结构:
- 未分化时呈悬浮生长,表面有微绒毛;经佛波酯(如TPA/PMA)处理后,迅速黏附并分化为巨噬细胞样形态,胞质内高尔基体、内质网和核糖体显著发育[2]。
- 分化后细胞体积增大,胞质/核比例升高,线粒体和溶酶体数量增加[3]。
2.表面标志物:
- 组成性表达Fc受体(IgG结合)和C3b受体,无表面或胞质免疫球蛋白[1]。
- 分化后表达单核/巨噬细胞标志(如CD14、CD11b),且TLR2响应显著增强[3]。
3.功能特性:
- 酶活性:组成性表达α-萘丁酸酯酶(NaF可抑制),TPA/PMA刺激后酶活性增强[1][2]。
- 吞噬功能:可吞噬乳胶颗粒、酵母和IgG包被的红细胞,分化后吞噬能力提升3倍以上[1][2]。
- 分泌功能:持续分泌溶菌酶,分化后产生M1/M2型细胞因子(如TNF-α、IL-10)[1][4]。
- 免疫调节:可恢复T细胞对Con A的响应,具有抗原提呈潜力[1][5]。
三、培养与储存
1.培养条件:
- 基础培养基:RPMI-1640 + 10%胎牛血清(FBS)[6]。
- 传代:悬浮生长,需定期吹散细胞团块[7]。
2.分化诱导:
- 经典方案:100 nM PMA处理48小时,诱导巨噬细胞样分化[2]。
- 优化方案:PMA刺激后撤药静置5天(PMAr),可获得更接近原代巨噬细胞的表型[3]。
3.冻存与复苏:
- 冻存液:90% FBS + 10% DMSO,液氮保存;原始冻存株(THP-1-O)分化能力优于长期传代株(THP-1-R)[2][5]。
四、研究应用领域
1.免疫调节研究:
- 模拟单核/巨噬细胞分化、极化及炎症响应(如TLR通路、炎性体激活)[8][9][10]。
2.疾病模型:
- 动脉粥样硬化:研究氧化低密度脂蛋白(oxLDL)对巨噬细胞极化的影响[11]。
- 痛风性关节炎:NLRP3炎性体激活机制[10]。
- 神经退行性疾病:β-淀粉样蛋白诱导的单核细胞成熟[12]。
3.药物筛选:
- 评估抗炎化合物、抗癌药物及纳米颗粒的免疫毒性[8][6]。
4.组织工程:
- 与干细胞、内皮细胞共培养,研究组织修复与免疫微环境[13]。
五、近几年研究进展(2018–2024)
1.分化优化:
- PMAr方案(PMA刺激后静置)显著提升THP-1分化的巨噬细胞与原代细胞的相似性,包括抗凋亡蛋白Mcl-1表达和TLR2响应强度[3][14]。
2.表观遗传差异:
- 2021年研究发现THP-1与原代单核细胞染色质构象(如TAD结构、染色质环)存在显著差异,导致分化相关基因表达偏移,提示永生化影响表观遗传[15]。
3.新型极化模型:
- 2023年建立M2样巨噬细胞模型,通过细胞因子组合(IL-4/IL-13)模拟肿瘤相关巨噬细胞(TAMs),用于癌症免疫治疗研究[9]。
4.生物材料互作:
- 磷酸钙陶瓷相变调控THP-1源性巨噬细胞极化方向,影响骨再生微环境[4]。
六、局限性与克服方法
1.与原代细胞的差异:
- 局限性:长期培养导致染色体结构异常、基因表达偏移(如炎症通路基因),分化后细胞仍缺乏原代巨噬细胞的吞噬效率和极化可塑性[14][15]。
- 克服方法:联合多组学(转录组+表观组)验证关键表型[15];采用PMAr方案提升功能相似性[3];开发THP-1与原代细胞共培养系统[13]。
2.分化诱导的争议:
- 局限性:PMA诱导可能过度激活炎症通路,干扰药物响应[14]。
- 克服方法:改用低剂量维生素D3(VD3)或细胞因子(如M-CSF)诱导分化[3][14]。
3.冻存影响:
- 局限性:反复冻存降低分化效率[2]。
- 克服方法:使用早期冻存株(THP-1-O),限制传代次数(<30代)[2][14]。
七、总结与展望
THP-1细胞系作为单核/巨噬细胞研究的经典模型,具备分化可塑性、操作便捷性和广泛的适用性,尤其在免疫调节、疾病机制和药物开发中不可或缺。然而,其永生化导致的表观遗传偏移和功能差异需谨慎解读[15]。未来方向:
1.开发基因编辑THP-1株(如CRISPR修正表观遗传位点)以提升生理相关性;
2.整合3D共培养系统模拟体内微环境[13];
3.探索单细胞测序在THP-1异质性研究中的应用[7]。
参考文献
1. Establishment and characterization of a human acute monocytic leukemia cell line (THP-1). Tsuchiya S, et al. Int J Cancer. 1980;26(2):171-172. [PMID: 6970727]
2. Induction of maturation in cultured human monocytic leukemia cells by a phorbol diester. Tsuchiya S, et al. Cancer Res. 1982;42(4):1530-1534. [PMID: 7060008]
3. The identification of markers of macrophage differentiation in PMA-stimulated THP-1 cells and monocyte-derived macrophages. Daigneault M, et al. PLoS One. 2010;5(1):e8663. [PMID: 20084270]
4. Macrophage polarization related to crystal phases of calcium phosphate biomaterials. Xiao L, et al. Biomaterials. 2021;276:121022.[ PMID: 34175743]
5. Establishment of an activated macrophage cell line, A-THP-1, and its properties. Tominaga T, et al. J Leukoc Biol. 1998;64(4):524-530. [PMID: 9766635]
6. Complexification of in vitro models of intestinal barriers, a true challenge for a more accurate alternative approach. Haddad MJ, et al. Int J Mol Sci. 2023;24(3):2806. [PMID: 36769035]
7. Determination of electrophysiological properties of human monocytes and THP-1 cells by dielectrophoresis. Mohamed R, et al. PLoS One. 2019;14(3):e0213127. [PMID: 30845240]
8. THP-1 cell line: an in vitro cell model for immune modulation approach. Chanput W, et al. Int Immunopharmacol. 2014;23(1):37-45. [PMID: 25205340]
9. Anti‐inflammatory mechanisms in cancer research: characterization of a distinct M2‐like macrophage model derived from the THP‐1 cell line. Scheurlen KM, et al. Cancer Immunol Immunother. 2023;72(11):3625-3638. [PMID: 37603021]
10. Nuclear receptor coactivator 6 is a critical regulator of NLRP3 inflammasome activation and gouty arthritis. Lee KG, et al. Cell Mol Immunol. 2024 Mar;21(3):227-244. [PMID: 38195836]
11. The effect of myeloperoxidase-oxidized LDL on THP-1 macrophage polarization and repolarization. Bazzi S, et al. Biochim Biophys Acta Mol Cell Biol Lipids. 2022;1867(2):159078. [PMID: 34756922]
12. Crouse NR. The role of amyloid-beta assembly state in monocyte maturation and smooth muscle cell degeneration [PhD thesis]. University of Kentucky; 2011.
13. Bogdanowicz DR. Designing the stem cell microenvironment for guided connective tissue regeneration [PhD thesis]. Rutgers University; 2017.
14. Convenience versus biological significance: are PMA-differentiated THP-1 cells a reliable substitute for blood-derived macrophages when studying in vitro polarization? Tedesco S, et al. Front Pharmacol. 2018;9:71. [PMID: 29593522]
15. Monocytic THP-1 cells diverge significantly from their primary counterparts: a comparative examination of the chromosomal conformations and transcriptomes. Liu Y, et al. Front Immunol. 2021;12:7650410. [PMID: 34804045]




