人卵巢癌细胞系A2780
发表时间:2025-07-18人卵巢癌细胞系A2780
一. 细胞起源与来源
1. 起源:A2780细胞来源于一名未接受化疗的子宫内膜样卵巢腺癌患者,是研究上皮性卵巢癌的经典模型[1]。
2. 分子特征:COSMIC数据库显示其p53突变频率为73%,高于浆液性癌细胞系(如SKOV3为51%)[1]。
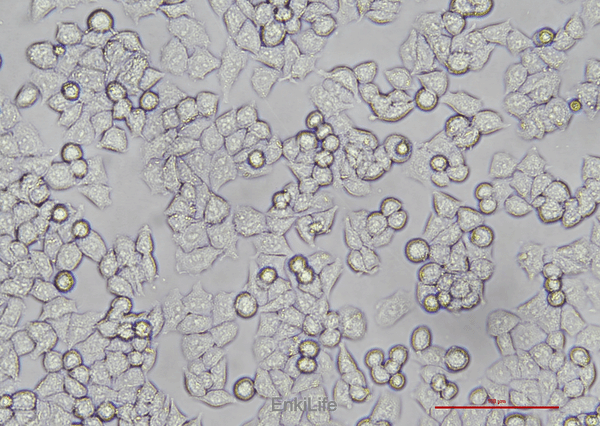
二. 生物学特性
1.形态与生长特性
l 细胞形态:呈单层贴壁生长,形态为扁平椭圆形上皮细胞[1]。
l 上皮-间质转化:紫杉醇耐药株(A2780/PTX)可发生上皮-间质转化(EMT),表现为纺锤形形态、粘附性降低、迁移侵袭能力增强[2]。
2.分子标志物
l Eph受体:EphA1蛋白表达呈弱阳性[3]。
l 耐药相关分子:
紫杉醇耐药株高表达N-cadherin、Vimentin、Twist,低表达E-cadherin[2]。
顺铂耐药株(A2780/DDP)中MACC1、BC200 lncRNA表达异常,导致凋亡蛋白(Bax/Bad)下调[4][5]。
l 干细胞特性:CD133+亚群高表达HMGA1,促进自我更新和耐药性[6]。
3.功能特性
l 迁移与侵袭:过表达Siva1可磷酸化Stathmin蛋白,显著抑制迁移和侵袭[7]。
l 耐药性:
对紫杉醇耐药机制依赖PI3K/AKT通路激活[2]。
顺铂耐药与HMGB1介导的保护性自噬、NAC-1/Gadd45通路失调相关[8]。
三. 培养与储存
1.培养基:RPMI 1640 + 10%胎牛血清 + 青霉素/链霉素(1:100),37℃、5% CO?培养[1]。
2.传代:每2–3天传代一次,细胞密度达1×10?/mL时需分瓶[1]。
3.耐药株筛选:紫杉醇耐药株用G418筛选(最佳浓度1100 μg/mL)[1]。
四. 研究应用领域
1.耐药机制研究:
EMT、PI3K/AKT通路与紫杉醇耐药[2]。
NAC-1/Gadd45γ/p38MAPK通路与紫杉醇耐药逆转[8]。
2.药物开发平台:
评估CRM197、磁黄连素(Magnoflorine)等逆转耐药的效果[8]。
测试双靶向纳米载体(FA-ZIF-90/DDP)的顺铂递送效率[9]。
3.干细胞研究:三维球体培养分离癌干细胞,研究HMGA1对耐药性的调控[6]。
五. 近几年研究进展(2020–2024)
1.耐药逆转新策略:
CRM197:通过上调Gadd45gip1/Gadd45γ/p38MAPK通路,下调NAC-1表达,逆转紫杉醇耐药[8]。
2.磁黄连素:抑制HMGB1介导的自噬,增强顺铂敏感性(A2780/DDP IC??从19.97 μg/mL降至9.51 μg/mL)。
3.双靶向纳米载体:FA-ZIF-90/DDP通过酸/ATP响应释放顺铂,靶向线粒体,显著抑制A2780/DDP移植瘤生长[9]。
4.基因靶向治疗:
过表达XAF1基因诱导G2/M期阻滞,增强紫杉醇敏感性[1]。
敲低MACC1通过抑制ERK1/2通路和P-gp表达,逆转顺铂耐药[5]。
5.应激反应研究:应激颗粒(SGs)通过调节线粒体未折叠蛋白反应(UPRmt),影响双PI3K/mTOR抑制剂(PKI-402)敏感性[10]。
六. 局限性与克服方法
1.局限性:
耐药机制复杂,涉及多通路交叉(如PI3K/AKT、EMT、自噬)[2]。
靶向治疗响应受p53突变状态影响,结果普适性受限[1]。
2.克服方法:
联合疗法:XAF1过表达联合紫杉醇可协同增效[1]。
纳米技术:双靶向载体提高药物肿瘤蓄积,减少全身毒性[9]。
多靶点抑制剂:抑制HMGA1或VEGFR3可克服干细胞耐药性[6][11]。
七. 总结与展望
A2780是研究卵巢癌耐药的核心模型,其EMT、干细胞特性及多通路激活是耐药主因。近年研究聚焦于纳米递送系统(如FA-ZIF-90)和天然化合物(如磁黄连素)的耐药逆转作用。未来研究方向包括:
1.开发针对p53突变亚型的个性化疗法[1]。
2.探索CAR-T细胞疗法(如靶向αFR的C4 CAR-T)的潜力[12]。
3.深入解析应激颗粒(SGs)与线粒体功能在耐药中的调控网络[10]。

参考文献
1. 刘娟, 等. XAF1过表达对A2780细胞生物学特性的影响. 中国癌症杂志. 2021;31(5):321-330.
2. Acquisition of paclitaxel resistance via PI3K-dependent EMT in A2780 cells. Du F, et al. Oncol Rep. 2013;30(4):1863-1870. [PMID: 23900717]
3. Decreased Eph receptor-A1 expression is related to grade in ovarian serous carcinoma. Jin Y, et al. Mol Med Rep. 2018 Apr;17(4):5409-5415.[PMID: 29393455]
4. Downregulation of BC200 contributes to carboplatin resistance. Wu D, et al. Int J Oncol. 2016;48(2):559-5610. [PMID: 26676611]
5. Knockdown of MACC1 increases cisplatin sensitivity. Zhang R, et al. Mol Med Rep. 2016;13(4):3523-3530. [PMID: 26935490]
6. HMGA1 regulates self-renewal and drug resistance in ovarian cancer stem cells. Kim DK, et al. Oncotarget. 2016;7(47):72752-72763. [PMID: 27765910]
7. Siva1 inhibits migration by phosphorylating Stathmin. Ma Y, et al. Oncol Rep. 2017;38(2):955-968. [PMID: 28656280]
8. CRM197 reverses paclitaxel resistance by inhibiting the NAC-1/Gadd45 pathway. Tang XH, et al. Oncol Rep. 2019;42(3):1163-1177. [PMID: 31254260]
9. Dual-Targeted Zeolitic Imidazolate Frameworks Drug Delivery System Reversing Cisplatin Resistance to Treat Resistant Ovarian Cancer. Xing Y, et al. Int J Nanomedicine. 2024 Jul 3;19:6603-6618. [PMID: 38979533]
10. Stress granules affect the dual PI3K/mTOR inhibitor response by regulating the mitochondrial unfolded protein response. Lin N, et al. Cancer Cell Int. 2024 Jan 18;24(1):38. [PMID: 3823882]
11. VEGFR3 inhibition chemosensitizes ovarian cancer stemlike cells through down-regulation of BRCA1 and BRCA2. Lim JJ, et al. Neoplasia. 2014 Apr;16(4):343-53.e1-2. [PMID: 24862760]
12. A fully human chimeric antigen receptor with potent activity against cancer cells but reduced risk for off-tumor toxicity.[J]. De-Gang, et al. Oncotarget, 2015, 6: 0.




