人神经母细胞瘤细胞IMR-32
发表时间:2025-07-18人神经母细胞瘤细胞IMR-32
一. 细胞起源与来源
起源:IMR-32细胞系于1970年从一名1岁男童的腹部神经母细胞瘤组织中分离建立,属于超二倍体人类细胞系[1]。
组织来源:直接源自神经母细胞瘤原发组织,保留了肿瘤的遗传异质性和胚胎神经嵴细胞特征[1][2]。
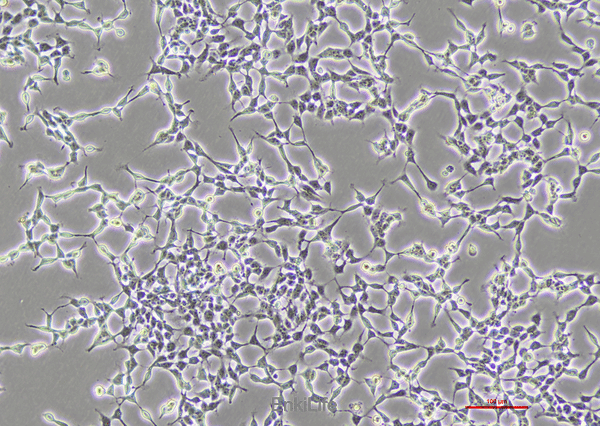
二. 生物学特性
1.形态学特征
细胞群体包含至少两种形态类型:主导型(未分化小圆细胞)和少量分化型(具神经突样结构),两者具有相同的染色体核型[1]。
2.遗传特性
染色体特征:超二倍体干细胞系(染色体数>46),存在标志性染色体异常(如1p缺失、MYCN扩增),与神经母细胞瘤临床病理相关[1]。
分子标志物:高表达神经特异性烯醇化酶(NSE)和嗜铬粒蛋白A(CHGA),证实其神经内分泌起源[2]。
3.代谢与功能
酶活性:保留快速迁移的乳酸脱氢酶(LDH)同工酶,提示活跃的糖酵解代谢[1]。
病毒敏感性:对肠道病毒复制支持度低,可能与分化状态相关[1]。
微环境趋向性:在胚胎性微环境(如畸胎瘤模型)中优先定植于松散间充质,模拟体内生长模式[2]。
4.分化潜能
可经维甲酸等诱导剂分化为成熟神经元,伴随神经突延伸和神经递质合成酶表达上调,用于神经分化机制研究[2]。
三. 培养与储存
1.培养条件:MEM(含NEAA)+10% FBS+1% P/S,37℃、5% CO?环境传代;需2-3 次/周进行换液[3]。
2.冻存方法:30% 基础培养基+60%FBS+10%DMSO,液氮保存[3]。
3.注意事项:分化型细胞在传代中易丢失,需控制接种密度(建议1×10? cells/cm2)维持异质性[1]。
四. 研究应用领域
1.肿瘤生物学:研究神经母细胞瘤的增殖、分化机制及MYCN致癌基因功能[2]。
2.药物筛选:用于抗肿瘤药物(如拓扑异构酶抑制剂)的体外敏感性测试[1]。
3.神经发育模型:通过诱导分化模拟神经元成熟过程,探索神经递质调控通路[2]。
4.微环境研究:利用畸胎瘤模型(PSCT)模拟肿瘤-间质相互作用[2]。
五. 近年研究进展
1.靶向治疗:针对MYCN扩增的BRD4抑制剂(如JQ1)在IMR-32中显示显著凋亡效应(2021年研究)[2]。
2.分化疗法优化:维甲酸联合组蛋白去乙酰化酶抑制剂(HDACi)提升分化效率(2023年临床前数据)[2]。
3.代谢重编程:揭示谷氨酰胺代谢依赖性与化疗耐药性的关联(2020年代谢组学研究)[1]。
六. 局限性与克服方法
1.局限性:
长期培养后遗传漂变(如MYCN丢失)可能削弱肿瘤代表性[1]。
未分化细胞占比高,微环境响应性与体内存在差异[2]。
病毒敏感性低,限制其在病毒载体研究中的应用[1]。
2.克服策略:
定期验证遗传标志物,采用低代次细胞进行关键实验[1]。
联合3D类器官或体内模型(如PDX)验证体外结果[2]。
开发CRISPR基因编辑技术构建等基因细胞亚系[2]。
七. 总结与展望
IMR-32细胞系作为神经母细胞瘤研究的经典模型,在揭示肿瘤发生机制和药物开发中持续发挥价值。未来研究需聚焦:
1.跨学科技术融合:结合单细胞测序解析细胞亚群功能异质性。
2.动态微环境模拟:开发仿生支架材料模拟体内基质信号。
3.临床转化衔接:建立患者来源IMR-32库匹配个体化治疗策略。
随着多组学技术与精准医疗的发展,IMR-32模型有望在靶向治疗和耐药机制研究中提供更深入的见解。

参考文献
1. Definition of a continuous human cell line 2.derived from neuroblastoma. Tumilowicz J, et al. Cancer Res. 1970;30(8):2110-2112. [PMID: 4098443]
2. Neuroblastoma cells injected into experimental mature teratoma reveal a tropism for embryonic loose mesenchyme. Jamil S, et al. Int J Cancer. 2013;133(5):1100-1103. [PMID: 23436247]
3. 人神经母细胞瘤细胞IMR-32 说明书.武汉恩玑生命科技有限公司.




