文献分享:多重免疫荧光表征肿瘤免疫微环境
发表时间:2025-12-16文献分享:多重免疫荧光表征肿瘤免疫微环境
背景
肿瘤免疫微环境(TME)的细胞组成、功能状态及空间分布是决定肿瘤进展与免疫治疗疗效的核心因素,精准解析TME特征已成为肿瘤研究的关键方向。然而,传统研究工具存在显著局限:单一免疫组化(IHC)仅能检测单靶点,无法呈现细胞间的互作关系;流式细胞术虽可实现多参数分析,但需解离细胞,丢失了至关重要的空间信息;早期多重荧光染色技术则受限于信号强度低、抗体物种兼容性差等问题,难以满足临床样本分析需求。在此背景下,基于酪酰胺信号放大(TSA)技术的多重免疫荧光(mIHC)平台应运而生,为TME的“全景式”解析提供了可能。
Viratham Pulsawatdi A 团队在《Molecular Oncology》上发表了题为 “A robust multiplex immunofluorescence and digital pathology workflow for the characterisation of the tumour immune microenvironment” 的研究,该研究以结直肠癌(CRC)福尔马林固定石蜡包埋(FFPE)组织为研究对象,基于TSA技术的 Opal 多重免疫荧光平台,构建并验证了一套从染色到图像分析的标准化流程,为肿瘤免疫微环境的精准表征提供了可靠方法。以下从技术本质、实验逻辑、核心发现及应用价值展开深度解析。
一、技术核心:多重免疫荧光TSA技术的原理与优势
TSA技术是mIHC实现高灵敏度检测的核心。其原理基于辣根过氧化物酶(HRP)催化反应:HRP与一抗结合后,催化酪酰胺分子发生氧化聚合,使荧光信号在抗原位点高效富集,实现信号放大。与传统IHC相比,该技术突破了以下瓶颈:
l 多重标记可行性:通过“一抗结合-信号放大-抗原变性”的循环流程,可在同一张组织切片上依次检测6-8种生物标志物,解决了传统IHC一次仅能检测单一靶点的局限。
l 高灵敏度特性:对低表达生物标志物的检测能力显著优于传统荧光染色,信号强度可达传统方法的10-100倍。
l 同物种抗体兼容性:TSA的信号放大不依赖抗体来源物种,可使用同一物种来源的多种一抗,大幅拓展了抗体选择的灵活性。
本研究中,Opal染料作为TSA技术的核心载体,通过与不同荧光通道匹配,结合多光谱成像与解混技术,实现了多重信号的精准区分,为后续数字分析奠定基础。与单一染色IHC、流式细胞术等技术相比,本研究采用的多重免疫荧光TSA技术展现出独特优势:
l 空间信息保留:在检测多重生物标志物的同时,完整保留组织形态和细胞空间定位关系,这是流式细胞术无法实现的,对分析肿瘤免疫细胞浸润模式至关重要。
l 定量准确性:结合数字图像分析软件QUPATH,可对免疫细胞表型进行定量统计,与传统IHC的相关性系数r?>0.9,验证了其定量可靠性。
l 高通量适配性:通过自动化染色仪和全切片扫描仪,实现从染色到成像的自动化操作,单样本从组织切片到结果输出可在24小时内完成,适配大样本队列研究。
二、实验设计
研究针对mIHC实验中“染色质量不稳定”“图像分析易产生偏差”等关键问题,设计了两种多重检测通道,系统优化并验证流程:
MP1(6重):CD3、CD4、CD8、CD20、细胞角蛋白(CK)、DAPI,聚焦T细胞亚群与B细胞、肿瘤细胞的共定位分析。
MP2(5重):CD4、CD68、FOXP3、CK、DAPI,用于解析调节性T细胞(Treg)与巨噬细胞的浸润特征。
三、结果展示
1. 染色顺序优化
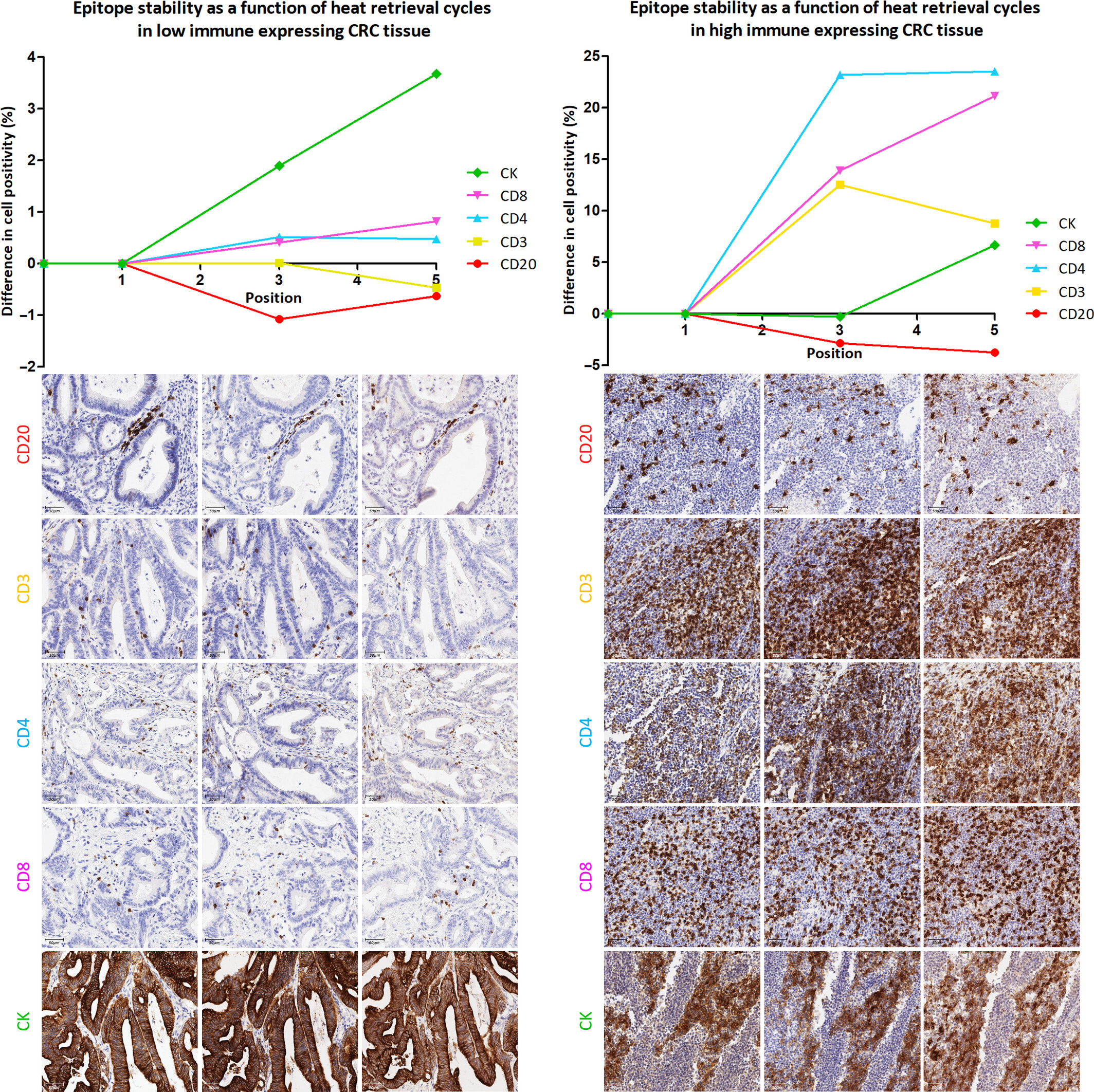
系统对比了低免疫浸润与高免疫浸润结直肠癌组织中,CD20、CD3等5种生物标志物在反复热诱导表位修复(HIER)后阳性细胞的检出率。
结果显示:a. 表位稳定性存在显著差异:CD20 表位稳定性最高,无需多次 HIER 修复,在第一次检出率稳定;CD3 表位稳定性次之,适合2次HIER 修复;CD4、CD8、CK 表位需多次 HIER 才能充分暴露。b. 免疫浸润水平影响较小:低/高免疫浸润 CRC 组织中,各标志物的表位稳定性趋势一致,说明该优化结果具有普适性。c. 染色位置关联检出效果:CD20 在多次 HIER 后检出率下降,说明表位已经变性;CD4 在第5次HIER 修复检出率达峰值,说明多次 HIER 后表位充分暴露。
该实验明确了 MP1中各抗体的最优染色顺序,解决了多重染色中“表位随 HIER 循环降解”的核心问题,为后续荧光染色的循环流程设计提供了直接依据,避免因染色顺序不当导致的假阴性结果。
2. 验证荧光染色的有效性
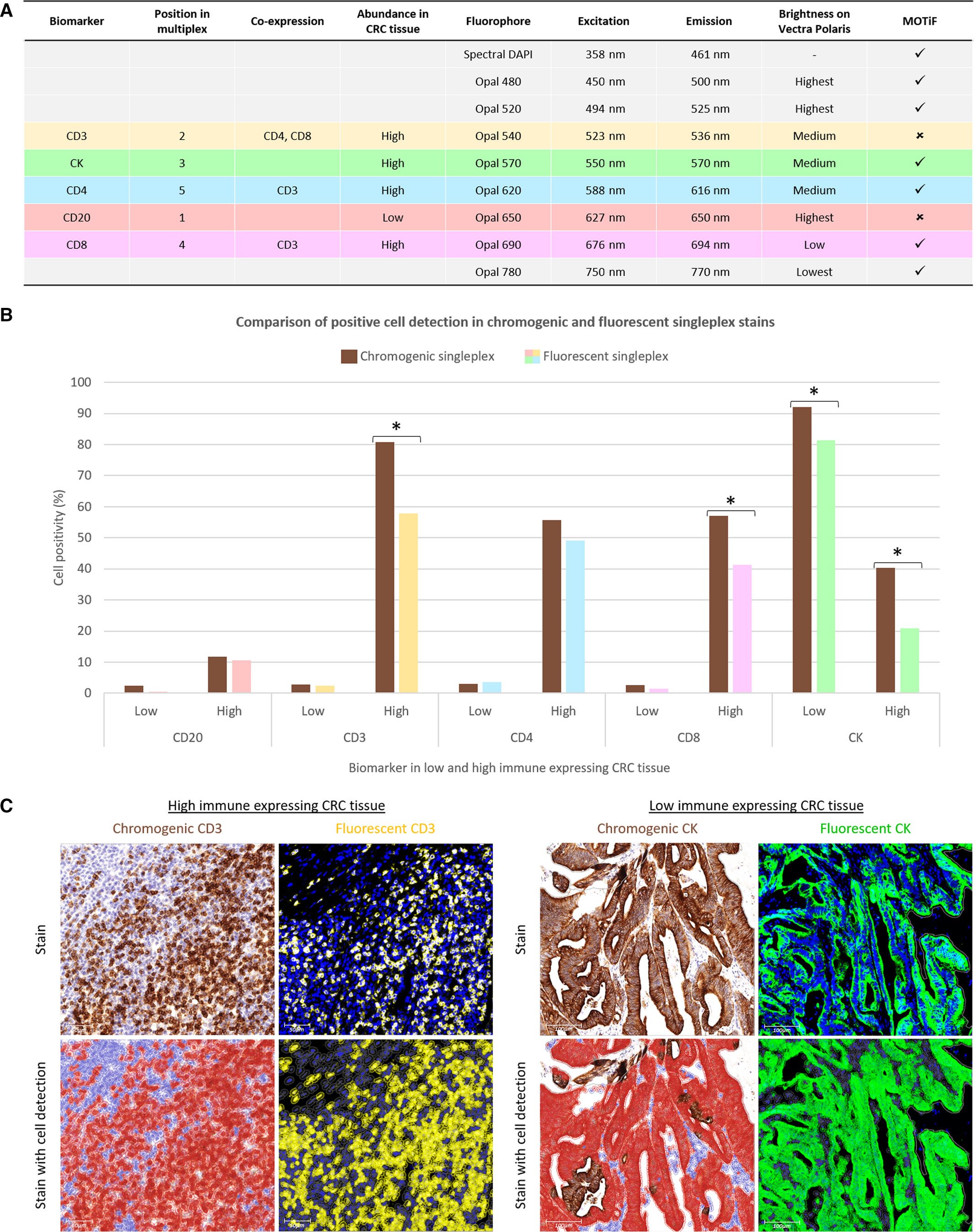
该实验通过三方面验证荧光单标技术的有效性:其一,依据抗体 - Opal 染料配对表,采用低丰度标志物(如 CD20)搭配高亮度染料、高丰度标志物(如 CD3、CK)搭配中低亮度染料的策略平衡信号强度,同时为功能相关标志物(如 CD3 与 CD4/CD8)选用光谱分离度高的染料以规避信号串扰;其二,柱状对比图显示,低 / 高免疫浸润结直肠癌组织中 5 种标志物的检测结果,在该技术与传统 DAB 显色免疫组化间高度一致;其三,代表性区域实拍图表明,传统 DAB 染色因细胞密集难以实现精准细胞分割,而荧光染色信号边界清晰,可借助软件准确判定细胞阴阳性。综上,荧光单标技术可替代传统免疫组化用于标志物检测,且在密集细胞区域的定量分析中更具优势,为后续多重荧光染色的可靠性提供了数据支撑。
3. 多重染色的干扰排除与流程确立
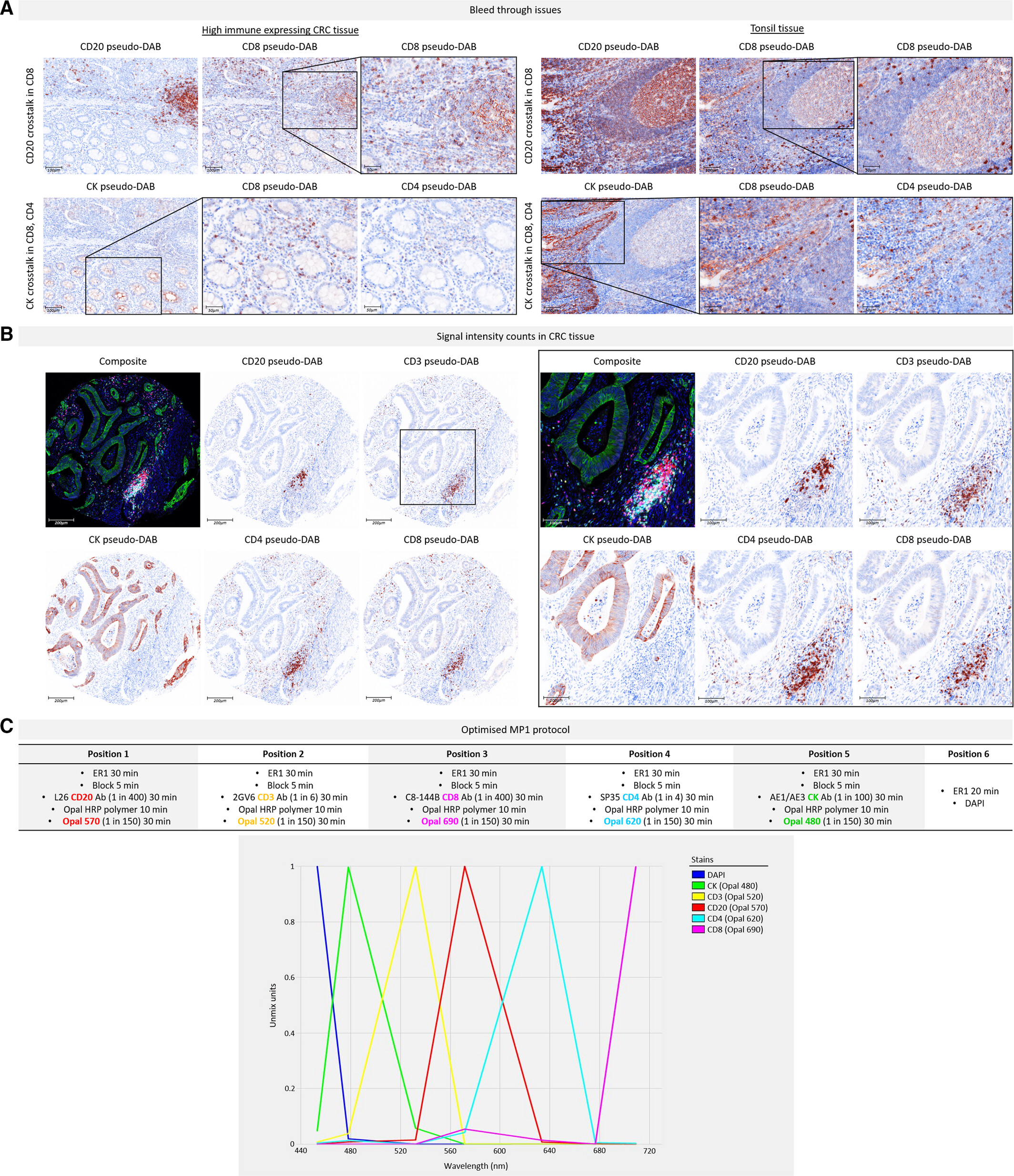
图 A 显示优化前 CD20 对 CD8、CK 对 CD4/CD8 存在明显信号干扰,其原因包括 CD20-Opal 650 与 CD8-Opal 690 同属 Cy5 通道引发光谱重叠,以及 CK 与 CD8 染色位置相邻导致的表位交叉反应,对照实验排除了抗体剥离不彻底的干扰。通过调整 Opal - 抗体配对、重排染色顺序(避免 CK 与 CD4/CD8 紧邻)、采用 ER1 温和剥离液等优化措施,信号串扰被完全消除。优化后图 B 中各标志物信号强度处于 20-25 计数的最优区间,所用 MOTIF Opal 染料无光谱重叠且扫描速度提升 20 倍,可满足高通量样本分析需求。
该实验系统解决了多重荧光染色的光谱串扰、表位交叉反应及背景干扰三大核心问题,经 9 轮优化和 40 张切片验证确立的MP1 实验流程,为后续高通量实验提供了稳定可靠的标准化方案。
4. 高通量成像的参数优化
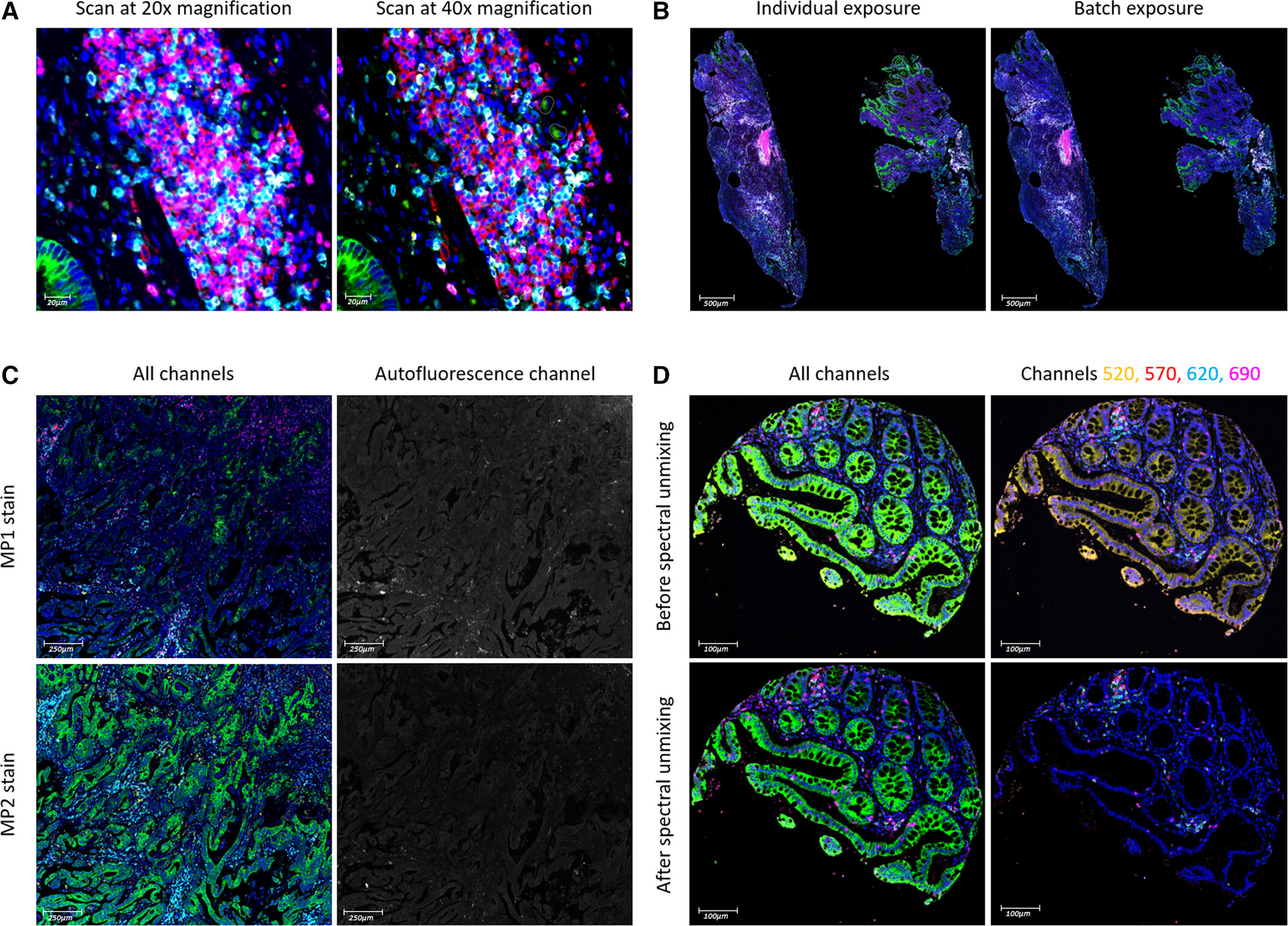
图A通过结直肠癌组织20倍与40倍扫描效果对比,发现20倍扫描的细胞群体检出率差异小于1%,且扫描耗时显著缩短,故确定20倍为标准成像倍数。B为单张切片独立曝光与批量曝光的染色效果对比,发现独立曝光与批量曝光的染色强度无显著差异(相关系数r?>0.9,P<0.05),且批量曝光模式可大幅减少成像准备时间,适用于高通量样本处理。C为MP1与MP2两种染色方案的结直肠癌组织对比图,结果发现MP1切片因厚度较大导致自发荧光增强,CK与CD4信号强度弱于MP2切片,因此证明3-4μm为最优切片厚度。D为光谱分解前后的结肠组织对比图,清晰展示CK(绿色)与CD3(黄色)的信号分离效果。
5. 多重荧光染色流程的最终验证
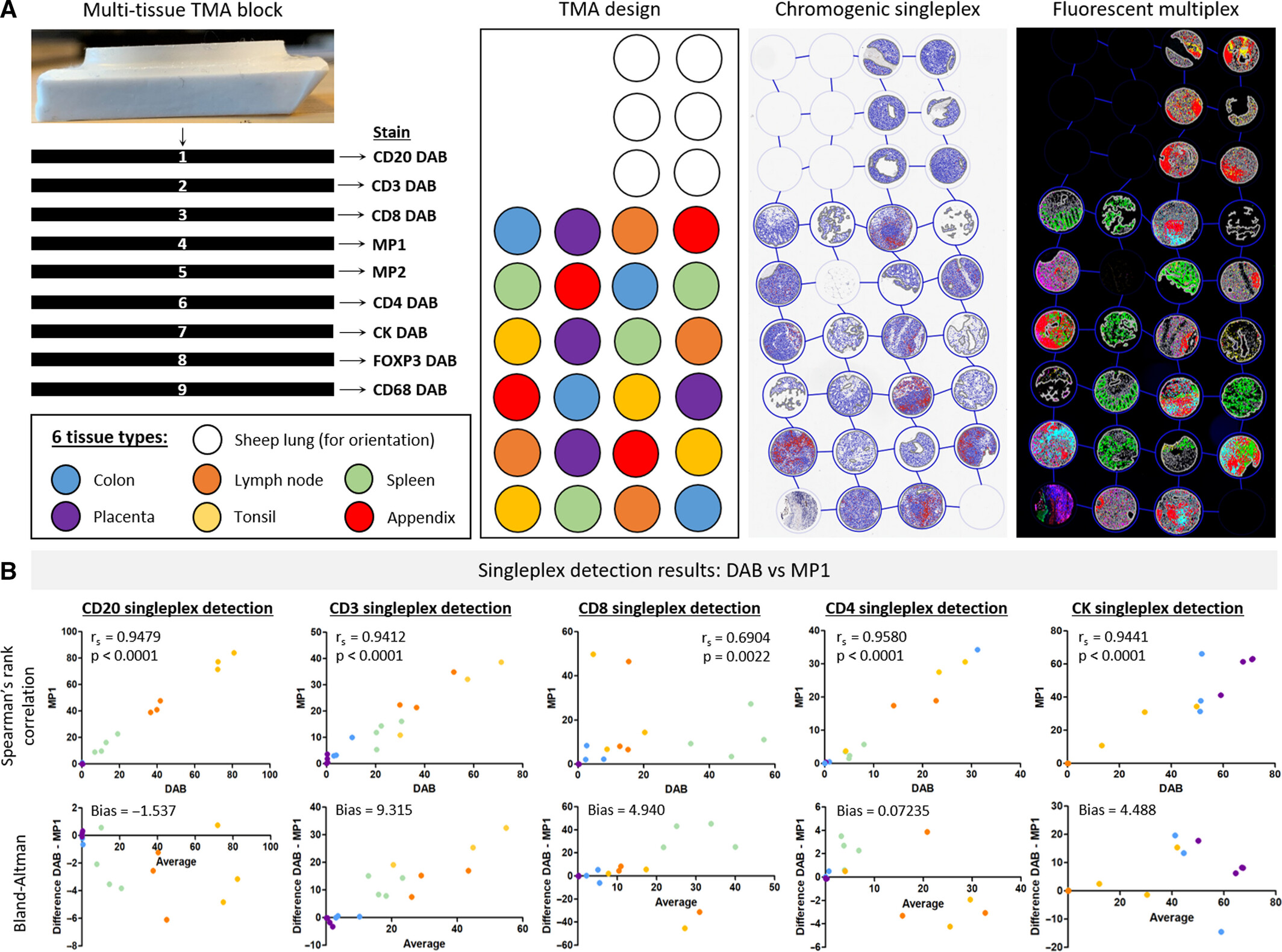
图A展示 9 张连续切片的处理方案(7 张用于传统 DAB 单标免疫组化、2 张用于多重荧光染色)及芯片布局(含 6 种正常组织与羊肺定位组织),B 通过 Spearman 相关分析与 Bland-Altman 一致性分析,系统对比各标志物在两种检测方法中的检出结果。检测结果显示,除 CD8(部分组织表位不稳定)与 FOXP3(表达量<0.5%)外,其余标志物两种检测方法的相关系数 r?均>0.9(P<0.0001),且所有标志物检测偏差均处于 95% 一致性界限内,证实多重荧光染色无系统性偏差,与传统免疫组化具有高度一致性与良好相关性。该图作为核心验证数据,从多组织类型、多标志物及定量一致性三个维度,确证了 MP1 与 MP2 实验流程的可靠性。
6. MP1 检测顺序对表型分析的影响
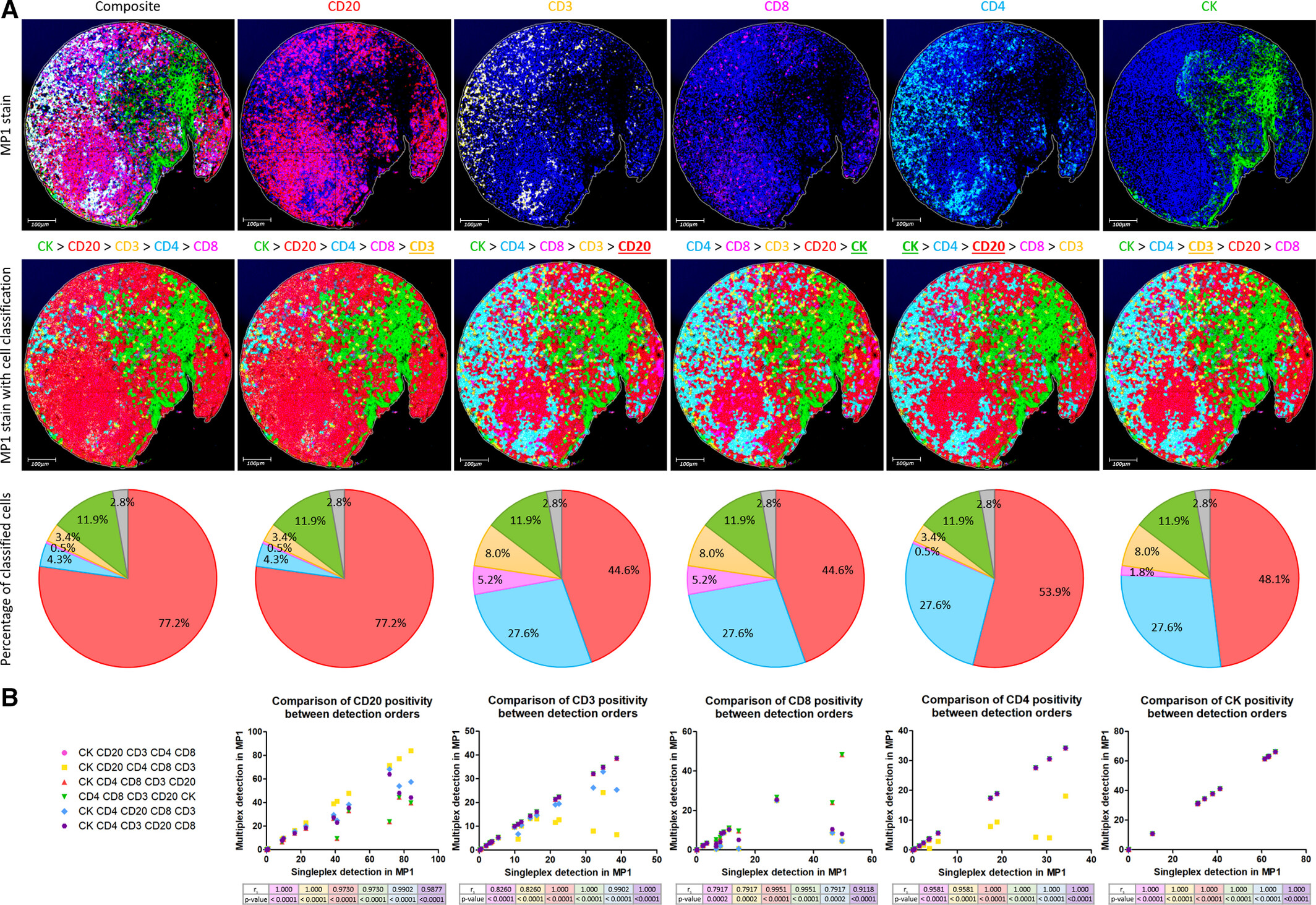
图A为扁桃体组织芯片的 MP1 染色图,同步呈现 6 种检测顺序下的表型分类饼图、原始染色图及细胞分类图。散点图量化对比不同检测顺序与单标结果的相关性。研究发现,检测顺序对分析结果存在显著影响,优先检测高表达标志物CD20会掩盖邻近低表达标志物CD8的信号,造成 CD20 阳性率高估、CD8 阳性率低估。最终确立的 “CK>CD4>CD3>CD20>CD8” 最优检测顺序,遵循 “先非免疫细胞标志物、后按泛免疫细胞→T 细胞亚群→B 细胞层级,且将易串扰标志物后置” 的逻辑,其表型分类结果与原始染色高度吻合,且各标志物分析结果与单标结果的相关性达到 r?>0.9(P<0.0001)。该图首次阐明检测顺序在多重荧光数字分析中的核心作用,建立基于细胞类型层级的检测顺序原则,有效解决分析方法不当引发的表型分类错误。
7. 从染色到数字图像分析
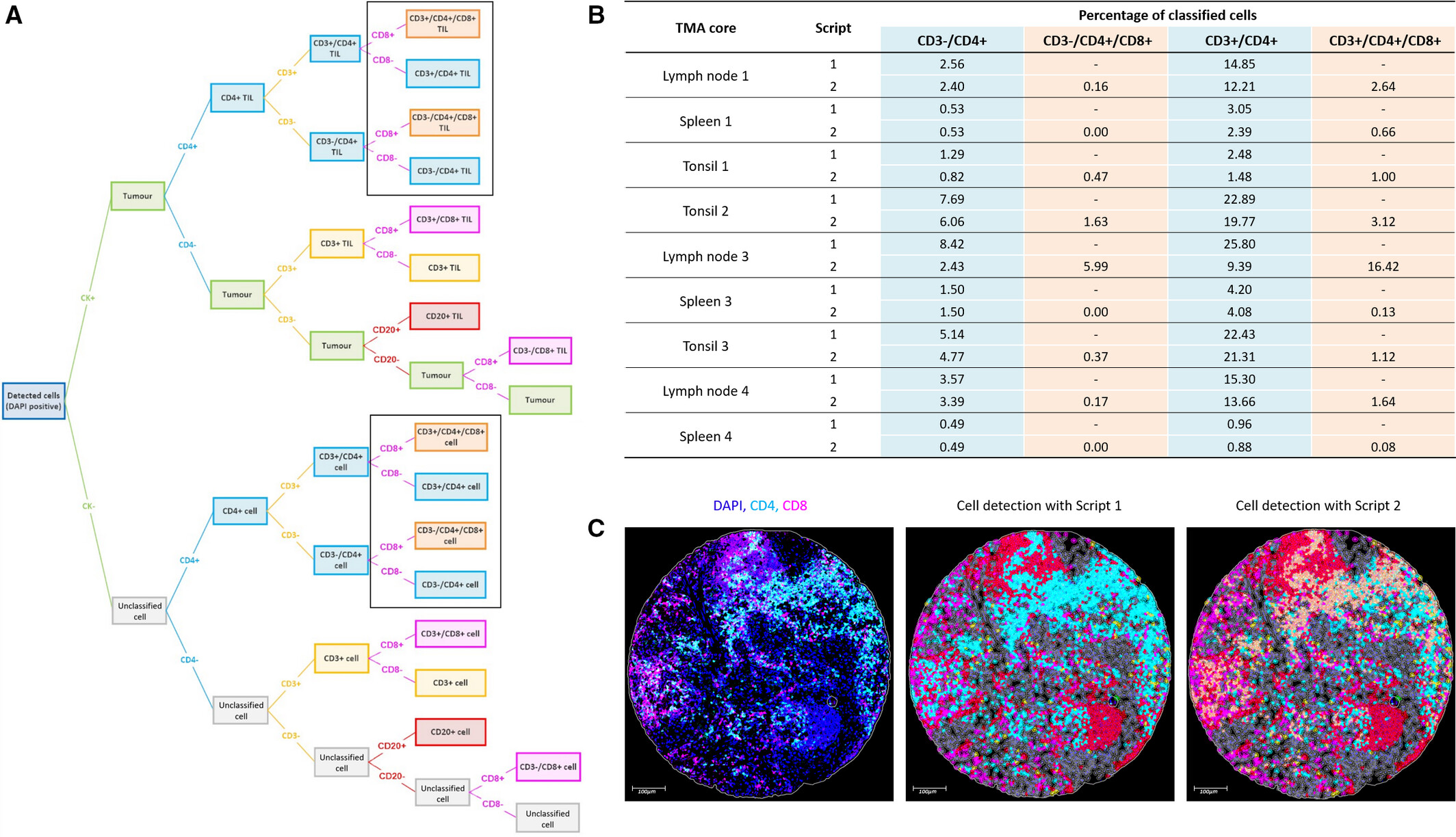
该分类决策树遵循 “细胞核识别→CK 阴性筛选→CD3 分型→CD4/CD8 细分”的层级化逻辑,保障细胞定义的清晰性。研究通过定制分析脚本实现预期表型与意外表型的全面覆盖,解决了数字分析中的表型漏判问题,新发现的 CD4?/CD8?双阳性细胞亚群为结直肠癌免疫微环境研究提供了新线索,凸显了多重荧光染色技术在挖掘新型生物标志物方面的独特优势。
四、总结
本研究通过系统优化与验证,构建了一套可靠的多重免疫荧光TSA技术工作流程,不仅证实了该技术在肿瘤免疫微环境研究中的核心价值,更为其标准化与临床转化提供了实践路径。其核心启示在于:多重免疫荧光TSA技术的优势不仅源于TSA的高灵敏度,更依赖“实验优化-分析标准化-多维度验证”的全流程控制。未来,随着算法迭代与技术融合,该技术将在“精准医学”领域实现更广泛的价值落地,为疾病机制研究与临床诊疗决策提供有力支撑。
参考文献
Viratham Pulsawatdi A, Craig SG, Bingham V, McCombe K, Humphries MP, Senevirathne S, Richman SD, Quirke P, Campo L, Domingo E, Maughan TS, James JA, Salto-Tellez M. A robust multiplex immunofluorescence and digital pathology workflow for the characterisation of the tumour immune microenvironment. Mol Oncol. 2020 Oct;14(10):2384-2402. doi: 10.1002/1878-0261.12764. Epub 2020 Sep 1. PMID: 32671911; PMCID: PMC7530793.
Enkilife mIF 技术服务
-
提供有偿代检和分析服务
-
承接多色配套服务