抗体的生物素标记保姆级教程 | EnkiLife小课堂
发表时间:2025-02-21标记原理
在一定pH范围内,生物素专一地与伯氨基反应(N-末端及赖氨酸残基侧链)形成稳定的酰胺键,从而实现与蛋白的偶联。结合生物素-亲和素系统,可广泛用于流式细胞术、荧光成像、蛋白质印迹和ELISA检测,以增加信号强度,获得更高的灵敏度。
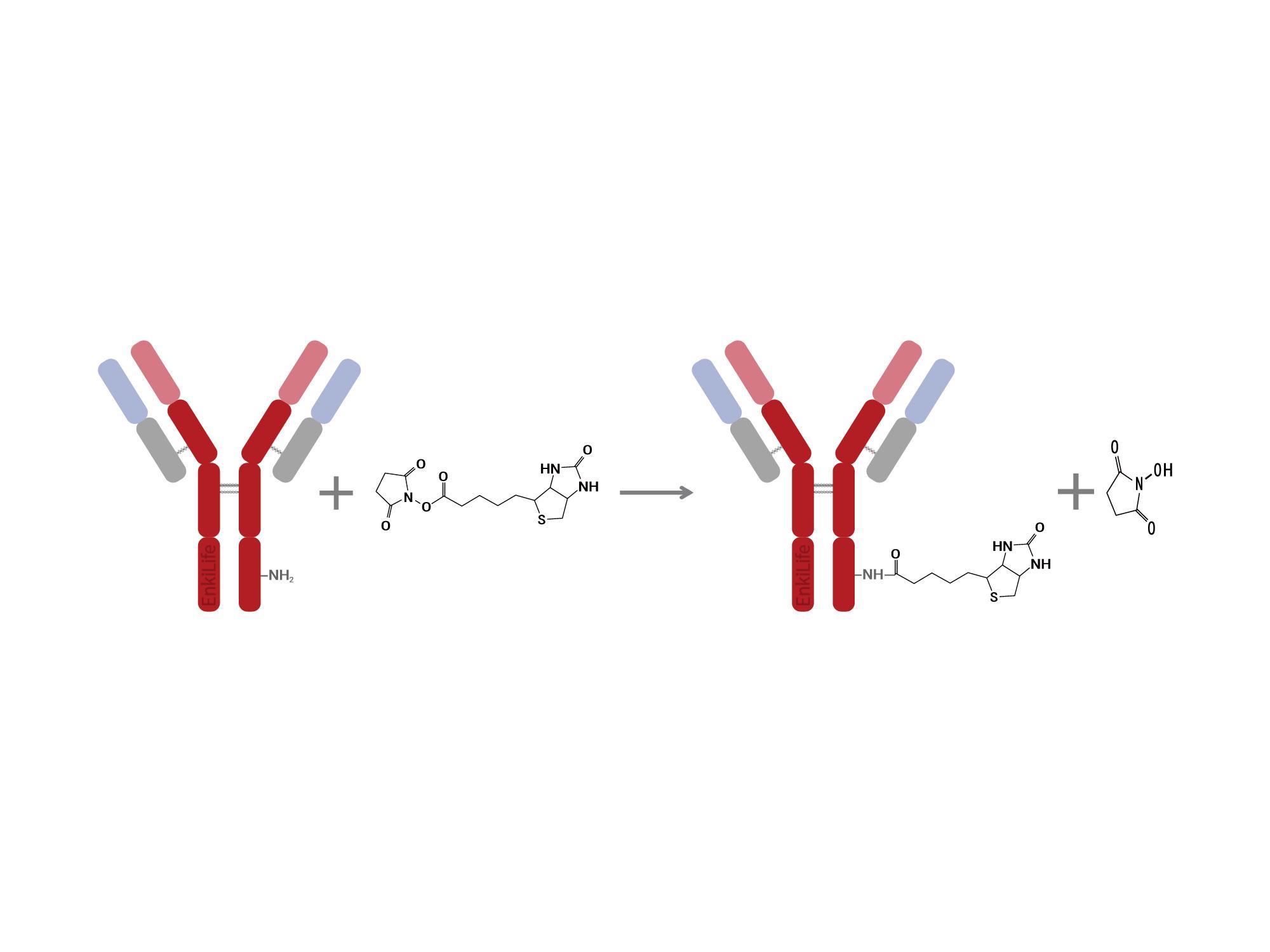
生物素标记使用量的计算
每个反应中生物素试剂的使用量取决于待标记蛋白质的量和浓度。例如,通过我们实验数据分析表明,标记2mg/ml 的抗体(IgG,150KD),使用生物素和抗体的分子比为 20:1 能达到最佳效果;其他蛋白的标记可以根据实际情况,参照此比例类推。
示例:标记 1 mg 的蛋白(浓度约 2 mg/mL),使用生物素和蛋白(150 KD)的分子比为 20:1,生物素的摩尔浓度为10 mM,应加入生物素量的计算方法:
1. 计算需要的生物素的物质的量n:

2. 计算需要的生物素的体积V:
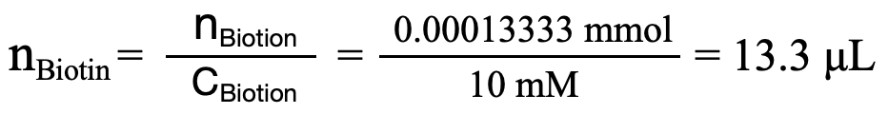
操作过程
·实验前准备
1. 仔细阅读标记试剂盒的使用说明书。
2. 待标记抗体中不得含有BSA等其它蛋白;叠氮钠、甘氨酸、Tris或其他任何有自由氨基的添加物会在操作的第一步中去除。
2. 按照生物素标记使用量的计算的公式计算所需要的生物素的量。
3. 提前20min从冰箱中取出试剂盒,使试剂盒各组分平衡至室温。。
4. 超滤管浸润:向干燥的超滤管滤芯中加入500μL标记缓冲液,室温放置10 min备用,在加入待标记物之前弃去标记缓冲液即可(整个标记过程中超滤管滤芯都应该保持湿润)。
5. 溶解生物素:用30μL DMF溶解0.1 mg生物素,静置10min,待其充分溶解,此时生物素的浓度为10 mM,盖好管子备用。
标记流程
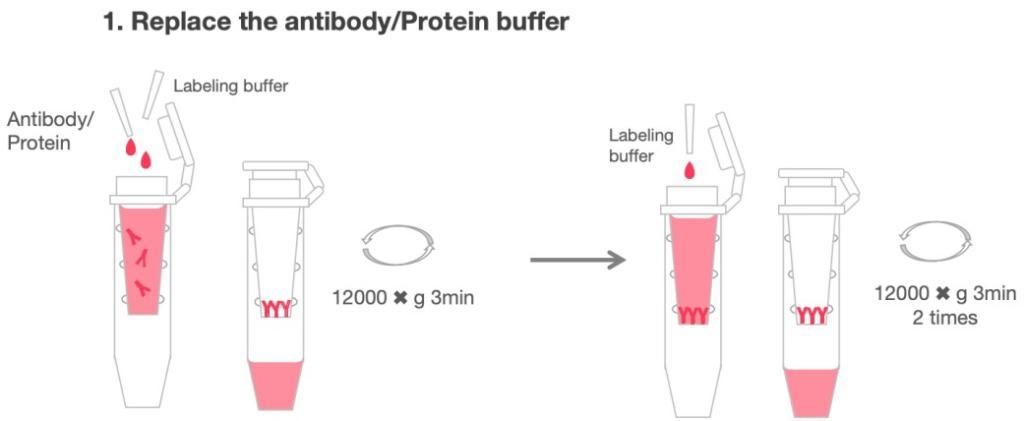
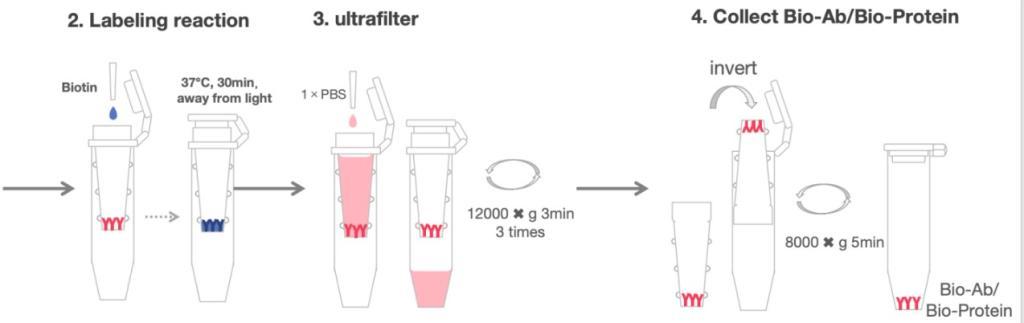
标记步骤(本操作步骤按照1mg抗体的量进行标记)
1. 取1mg待标记抗体于超滤管中,并加入不超过超滤管最大体积的标记缓冲液,12,000g 离心3min;可以重复此步骤3次;最后一次超滤完成,加入0.5mL标记缓冲液调整抗体的浓度到2mg/mL左右。
2. 加入13.3μL的10 mM生物素至上述超滤管中,并轻轻吹打混匀。放入37℃恒温箱中避光温育 30min。
3. 12,000 x g 离心 10min。
4. 加入适量1×PBS至上述超滤管中,并轻轻吹打混匀,12,000g 离心3min,重复此步骤3次。
5. 收集超滤管中的溶液(即生物素标记的抗体),加 0.2 mL 1×PBS 至超滤管中,轻轻吹打。将超滤管倒置于另一个收集管中,8000×g 离心5min。收集管中得到的溶液,即为生物素标记的抗体。纯化后的标记抗体可采用 A280 或 BCA 法测定蛋白浓度。
6. 向标记后的抗体中加入保存液,-20°C保存。
注意事项
1. 请根据待标记蛋白的分子量选择合适的试剂盒,本试剂盒来自EnkiLife(货号:RE80002),提供50 KD的超滤管。
2. 生物素易受潮水解失效,应密封置于-20°C 或-80°C保存。为防止水蒸气冷凝到生物素中,实验前将其移至室温平衡。
3. 溶解的生物素最好一次性使用完,如果使用不完可以密封后放在-20℃的冰箱内,一月内可以使用,但是标记效率会降低。生物素助溶剂使用完之后需要立即密封保存,防止吸潮。
4. 本试剂盒也可标记其它含有游离氨基的蛋白,具体标记比例根据待标记物中可用氨基的数量确定或者设置不同摩尔比例进行标记。
5. 本试剂盒标记推荐的生物素和蛋白(150KD)的最佳分子比为 20:1,可确保生物素能标记上蛋白,最佳标记比例可能根据蛋白的差异而不同,用户可根据实际情况优化。
产品特点
★ 快速:整个过程最快仅需 90 min。
★ 方便:本生物素标记试剂盒提供了生物素标记所需全部试剂;生物素已活化可直接使用;用超滤管离心脱盐和去除游离的生物素,无需透析等繁琐工序。
★ 使用灵活:既可用于微量标记又可大量标记,每支超滤管每次可标记0.1-1mg蛋白。
★ 脂溶性:本试剂盒内生物素为脂溶性,某些实验中,需要生物素标记的蛋白进入细胞膜内进行反应,此种标记方式相对比较有效。




