人心肌细胞AC16
发表时间:2025-07-14人心肌细胞AC16
一、细胞起源
人心肌细胞AC16来源于成人原代心肌细胞,具有较长的细胞周期停滞状态,类似于成人心肌细胞的特性,即细胞增殖能力较低,处于多倍体状态,其在心肌细胞损伤、心肌纤维化、心肌缺血再灌注损伤、心肌肥厚等病理过程中的作用已被大量研究证实。该细胞系被广泛认为是研究心血管疾病的理想工具。
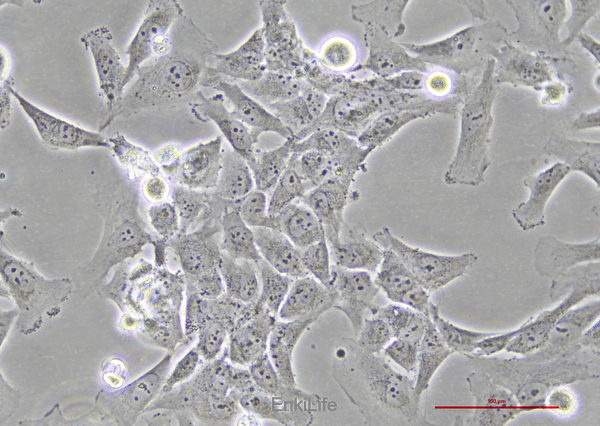
二、生物学特性
1. 形态与生长特性
l 形态:典型的成人心肌细胞形态,呈长杆状,细胞核呈椭圆形,细胞质内含有丰富的肌原纤维和肌节结构。
l 生长特性:表现为细胞周期停滞,多为二倍体或多核细胞,细胞增殖能力较弱[10]。
2. 功能保留
AC16细胞保留了心肌细胞的基本功能,如收缩、钙离子调控、线粒体功能等。研究表明,AC16细胞在缺氧、缺血再灌注、药物毒性等刺激下表现出类似成人心肌细胞的反应,如细胞凋亡、氧化应激、炎症反应等[1][4][7]。
3. 质量验证
l 病原体检测:对甲型、乙型、丙型肝炎病毒、HPV-16、HPV-18及HIV-1 & 2呈阴性,支原体检测阴性。
l STR鉴定:通过STR基因分型技术,对多个核心位点(如D5S818、VWA、THO1、AMEL、TPOX等)进行等位基因大小分析,确保细胞遗传背景的唯一性和稳定性[12]。通过Western Blot检测肌钙蛋白T、肌球蛋白轻链等心肌特异性蛋白的表达,以确认细胞的纯度和功能状态[10]。
三、培养与储存
1. 培养基与条件
l 培养基:DMEM为主,补充2%-10%胎牛血清(FBS),部分实验室添加1%青霉素/链霉素(P/S)[12]。
l 培养条件:温度为37℃,CO?浓度为5%。在缺氧条件下(1% O? + 5% CO? + 94% N?),AC16细胞可用于模拟心肌缺血再灌注损伤[4][10]。
2. 冻存与复苏
AC16细胞可采用标准的细胞冻存方法进行保存,通常使用含10% DMSO的培养基进行冻存。复苏时,将细胞在37℃水浴中快速解冻,随后加入预温的培养基进行培养[10]。
四、研究领域
1. 心肌缺血再灌注损伤:AC16细胞被用于研究心肌缺血再灌注损伤的机制,如氧化应激、炎症反应、细胞凋亡等[1][4]。
2. 心肌纤维化:AC16细胞在研究PM2.5和高脂饮食联合暴露对心肌纤维化的影响中发挥了重要作用[1]。
3. 心肌毒性研究:AC16细胞被用于评估多种药物(如多柔比星、山豆根酮等)对心肌细胞的毒性作用[5][9]。
4. 心肌细胞凋亡与自噬:AC16细胞在研究METTL3、circ_0020887等基因对心肌细胞凋亡和自噬的影响中具有重要价值[7][8]。
5. 心肌细胞信号通路研究:AC16细胞被用于研究多种信号通路(如JAK2/STAT3、PI3K/Akt、MAPK等)在心肌细胞损伤中的作用[2][4][6]。
五、研究进展(2021-2025年)
1. miR-330-5p对心肌缺血再灌注的保护作用
2024年,遵义市第一人民医院心内科的研究表明,miR-330-5p通过抑制MAPK信号通路,调控ALDH2表达,从而保护心肌细胞免受缺血再灌注损伤[4]。
2. circ_0020887通过miR-370-3p/CYP1B1轴调节心肌细胞损伤
2024年,Huiqin Chen等发现,circ_0020887通过海绵效应结合miR-370-3p,进而调控CYP1B1的表达,从而影响心肌细胞的氧化应激和凋亡[8]。
3. Siat7A通过内质网应激促进心肌肥厚
2023年,大连医科大学的研究表明,Siat7A通过激活内质网应激信号通路(PERK、IRE1、ATF6)促进HIF-1α的表达,从而导致心肌肥厚[6]。
4. FGD5-AS1通过miR-195/RORA轴抑制心肌缺氧损伤
2020年,XINYONG CAI等发现,FGD5-AS1通过调控miR-195/RORA轴,抑制心肌缺氧诱导的氧化应激和凋亡[3]。
5. Lnc-PXMP4-2-4通过JAK2/STAT3信号通路保护心肌细胞
2023年,Hong Zhang等发现,Lnc-PXMP4-2-4通过激活JAK2/STAT3信号通路,抑制心肌细胞凋亡,从而发挥保护作用[2]。
六、局限性与克服方法
1. 局限性
l 细胞增殖能力弱:AC16细胞处于细胞周期停滞状态,难以进行大规模扩增[10]。
l 异质性:AC16细胞在体外培养过程中可能出现一定程度的异质性,影响实验结果的可重复性[10]。
l 缺乏自发搏动:AC16细胞缺乏自发搏动能力,无法完全模拟成人心肌细胞的电生理特性[10]。
2. 克服方法
l 使用诱导多能干细胞(hiPSC)衍生心肌细胞:近年来,hiPSC-CMs因其更接近成人心肌细胞的特性,被广泛用于替代AC16细胞[10]。
l 优化培养条件:通过添加特定的生长因子或使用旋转磁场刺激(如MTS系统),可以促进AC16细胞的成熟和功能表达[11]。
l 结合体内模型:将AC16细胞与动物模型结合,可以更全面地研究心肌细胞的病理生理过程[1]。
七、总结与展望
AC16细胞作为研究心肌细胞损伤和功能的重要工具,已在多个心血管疾病领域取得了显著进展。然而,其在细胞增殖、异质性、自发搏动等方面的局限性仍需进一步优化。未来的研究方向包括:
l 开发更接近成人心肌细胞特性的细胞模型:如hiPSC-CMs、诱导多能干细胞衍生心肌细胞等[10]。
l 探索新型药物或基因调控手段:如miRNA、circRNA、lncRNA等在心肌细胞保护中的作用[2][7][8]。
l 结合体内模型进行综合研究:通过体内实验验证体外实验结果,提高研究的临床转化价值[1]。

八、参考文献
1. 蒋金金,梁爽,李洋,等.高脂饮食和PM2.5联合暴露对心肌纤维化的影响及机制研究.2019全国呼吸毒理与卫生毒理学术研讨会论文集,2019.
2. Zhang H, Guo Q, Feng G, et al. Lnc-PXMP4-2-4 alleviates myocardial cell damage by activating the JAK2/STAT3 signaling pathway. Heliyon. 2023 Jul 26;9(8):e18649. [PMID: 37560637]
3. Cai X, Zhang P, Wang S, Hong L, et al. lncRNA FGD5 antisense RNA 1 upregulates RORA to suppress hypoxic injury of human cardiomyocyte cells by inhibiting oxidative stress and apoptosis via miR 195. Mol Med Rep. 2020 Dec;22(6):4579-4588. [PMID: 33174051]
4. 遵义市第一人民医院心内科.miR-330-5p通过抑制MAPK通路发挥对心肌缺血再灌注的保护作用[J].黑龙江医学,2024.
5. 袁文琳,黄峥蕊,肖思佳,等.山豆根黄酮类成分对斑马鱼的急性毒性研究[J].中草药,2021.
6. 大连医科大学.Siat7A通过内质网应激信号通路激活HIF-1α促进心肌肥厚[D].大连医科大学,2023.
7. 周钰,白峰华,张君等.甲基化转移酶样蛋白3在急性心肌梗死患者外周血中的表达及对缺氧缺血所致心肌细胞损伤的调节作用[J].广西医学,2021.
8. Chen H, Cheng Z, Wang M, et al. Circ_0020887 Silencing Combats Hypoxic-Induced Cardiomyocyte Injury in an MiR-370-3p/CYP1B1-Dependent Manner. Int Heart J. 2024 Mar 11. Advance Publication.
9. 袁海涛,张廷芬,侯明月等.PGC-1a在多柔比星引起的心肌细胞线粒体毒性中的作用[J].中国药理学与毒理学杂志,2013.
10. Yang H, Yang Y, Kiskin FN, et al. Recent advances in regulating the proliferation or maturation of human-induced pluripotent stem cell-derived cardiomyocytes. Stem Cell Res Ther. 2023 Aug 30;14(1):228. [PMID: 37649113]
11. Song M, Kim J, Shin H, et al. Development of Magnetic Torque Stimulation (MTS) Utilizing Rotating Uniform Magnetic Field for Mechanical Activation of Cardiac Cells. Nanomaterials (Basel). 2020 Aug 27;10(9):1684. [PMID: 32867131]
12. 人心肌细胞AC16说明书. 中国科学院典型培养物保藏委员会细胞库/干细胞库.




